
Adiposidad y disglucemia | 23 FEB 20
¿Qué es la enfermedad crónica de origen cardiometabólico?
Un modelo de enfermedad crónica de origen cardiometabólico que proporciona una base para una focalización terapéutica temprana y sostenible y mitigar el desarrollo de las enfermedades CV
Autor/a: J. Mechanick, M. Farkouh, J. Newman y W. Garvey Fuente: J Am Coll Cardiol. 2020 Feb 11;75(5):525-538 Cardiometabolic-Based Chronic Disease, Adiposity and Dysglycemia Drivers
Destacados
|
¿Qué es la enfermedad crónica de origen cardiometabólico?
En esta revisión, el enfoque se centrará en los eventos metabólicos que se pueden agrupar en distintas etapas de las enfermedades crónicas, susceptibles de atención preventiva, para optimizar los resultados clínicos de enfermedad coronaria (EC), insuficiencia cardíaca (IC) y fibrilación auricular (FA).
La ECV es la principal causa de muerte en el mundo. Las disminuciones en las tasas generales de mortalidad por ECV se han asociado con estrategias efectivas de prevención primaria. En un documento de llamado a la acción, se presentaron múltiples fallas del sistema de atención de la salud, de las cuales: "la falta de modificaciones en los factores de riesgo" fue la más impactante. En muchos pacientes, el tratamiento de la ECV comienza con la aparición de eventos como angina, síndrome coronario agudo, accidente cerebrovascular, insuficiencia cardíaca congestiva funcional clase III / IV o enfermedad vascular periférica sintomática.
Las excepciones incluyen el abandono del hábito de fumar y la reducción basada en el riesgo del colesterol de lipoproteínas de baja densidad (LDL) (LDL-c) como intervenciones preventivas. Sin embargo, la disminución de los niveles de LDL-c mediante el tratamiento con estatinas en los ensayos de resultados cardiovasculares dio como resultado una reducción del riesgo promedio de solo un 30%, dejando un grado preponderante de riesgo residual desatendido.
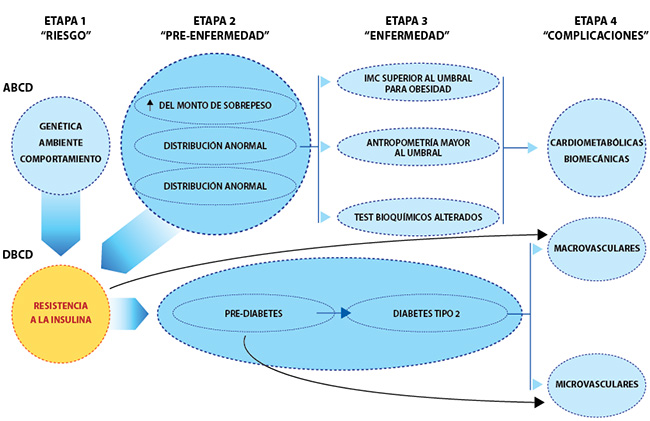
Se necesitan estrategias de prevención más efectivasEn este sentido, la consideración importante es que la ECV representa un proceso de enfermedad crónica que comienza temprano en la vida con oportunidades para la prevención primaria, secundaria y terciaria que puede mitigar la ocurrencia de eventos en la etapa final. En esta revisión, se establece un modelo médicamente accionable, consistente con la evidencia actual que aborda la fisiopatología, que delinea las interrelaciones entre la obesidad, la diabetes tipo 2 (DM2) y las enfermedades cardiovasculares.
Este nuevo modelo describe por primera vez enfoques integrales para la prevención primaria, secundaria y terciaria centrados en las ECV (específicamente EC, IC y FA) como etapa final de este proceso de enfermedad crónica.
Esta nueva entidad se reconceptualiza como enfermedad crónica de base cardiometabólica (CMBCD), cuya anomalía central impulsa la progresión de la resistencia a la insulina.De hecho, el riesgo residual después de la terapia con estatinas puede atribuirse en gran medida a la resistencia a la insulina.
El modelo CMBCD aborda los factores de riesgo modificables que pueden mitigar el sufrimiento del paciente y los costos sociales de la ECV en lugar de la excesiva dependencia de intervenciones tecnológicas costosas e invasivas una vez que se expresan por completo las enfermedades.
La resistencia a la insulina está en la intersección de la adiposidad anormal y la disglucemia. Estos determinantes metabólicos se derivan de los determinantes primarios (genética, medio ambiente y comportamiento), y conducen a la progresión de CMBCD. Específicamente, la adiposidad anormal se incorpora en el término de diagnóstico recientemente propuesto para obesidad: enfermedad crónica basada en adiposidad (ABCD) y la disglucemia progresa según el modelo definido por enfermedad crónica basada en disglucemia (DBCD).
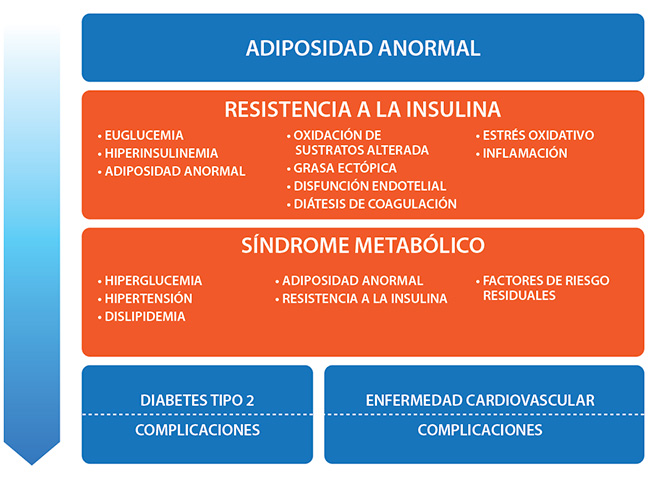
Determinantes primarios de CMBDC
> GENÉTICA
Hay muchos factores moleculares asociados con los efectos cardiometabólicos. Sin embargo, la mayoría de la herencia de enfermedades crónicas no se explica por los hallazgos de estudios de asociación del genoma. Más bien, la herencia familiar depende más de riesgos modificables. Estas interacciones también varían con diferentes etnias y comportamientos, que proporcionan un contexto adicional para la expresión de rasgos fenotípicos. El uso de la genética del sistema para identificar los impulsores moleculares es útil, pero es esta compleja interacción de genes, entorno y comportamiento lo que en última instancia determina el riesgo y el fenotipo de la enfermedad.
La regulación epigenética proporciona una explicación biológica de cómo los genes y el entorno interactúan para crear un fenotipo específico.Por ejemplo, las modificaciones epigenéticas que surgen en el útero con diabetes gestacional materna pueden conferir un fenotipo de resistencia a la insulina en la descendencia, que persiste en la edad adulta y puede conducir a DM2, obesidad y ECV.
En un metanálisis, se descubrió que la obesidad infantil es un factor de riesgo de ECV basado en asociaciones con ciertos factores de riesgo en adultos (presión arterial sistólica [PA], presión diastólica, colesterol total, lipoproteína de alta densidad [HDL], LDL, no -HDL y triglicéridos). De hecho, los recién nacidos de mujeres obesas tenían tabiques intraventriculares más gruesos y una función cardíaca reducida.
Además de la cantidad de adiposidad (reflejada por el IMC), la distribución androide de la adiposidad se asoció preferentemente con una mayor resistencia a la insulina, lo que condujo a una mayor insulina en ayunas, triglicéridos, HDL, interleucina (IL) -6, proteína quimioatrayente de monocitos (MCP) y niveles de proteína C -reactiva, y también se correlacionó con diferencias en la expresión génica.
> AMBIENTE
El entorno construido (o artificial) y no físico (cultural) proporciona el contexto para la expresión de factores de riesgo genéticos cardiometabólicos.Las siguientes variables están asociadas con la ECV:
- estratos socioeconómicos más bajos.
- acceso reducido a una atención médica de calidad.
- bajos niveles de educación y alfabetización.
- regiones de alto consumo de alcohol.
- hábitats tanto urbanos (para niños) como rurales (con olas de calor o frío que afectan acceso a la atención médica).
- contaminación del aire y del ruido.
- mala calidad del agua potable.
| Las toxinas ambientales o los disruptores endocrinos pueden afectar el riesgo de DM2 al modular la expresión génica, así como al interactuar con el tráfico molecular y otras vías fisiopatológicas para influir en los resultados CV. |
> COMPORTAMIENTO
Una vez que la expresión fenotípica de factores genéticos y ambientales inicia un proceso de enfermedad, los comportamientos individuales no solo pueden modular esa expresión, sino que también pueden brindar oportunidades para la intervención.
Pickens et al. presentaron en 2018 resultados de una encuesta de EE. UU. de 2015 sobre conductas de riesgo para la salud en mayores de 18 años de edad que proporcionó el contexto para los determinantes genéticos y ambientales de enfermedades crónicas, especialmente aquellos basados en vías cardiometabólicas.
El consumo de tabaco fue de 9.0% a 27.2%, el consumo excesivo de alcohol fue de 11.2% a 26.0%, la ausencia de actividad física en el tiempo libre 17.6% a 47.1% y el bajo consumo de frutas o verduras 33.3% a 55.5% o 16.6% a 31.3%, respectivamente.
Los puntajes más altos de la calidad de la dieta que reflejan un aumento en los patrones de alimentación saludable se asociaron con un IMC, una relación cintura-altura y la circunferencia de la cintura más bajos.
Determinantes metabólicos
1. ENFERMEDAD CRÓNICA BASADA EN LA ADIPOSIDAD
Adiposidad anormal. ABCD es un término de diagnóstico más científicamente preciso, procesable y menos estigmatizado que la obesidad. ABCD es una enfermedad crónica progresiva compleja que involucra anormalidades en la cantidad, distribución y función del tejido adiposo caracterizada por complicaciones cardiometabólicas, biomecánicas o psicológicas que confieren morbilidad y mortalidad.
El diagnóstico de ABCD tiene 2 partes:
|
La cantidad anormal de adiposidad reflejada por el aumento de peso y el IMC está relacionada con la ECV, pero esto no es sencillo porque la masa grasa excesiva no es un factor necesario ni suficiente. No todos los pacientes con obesidad son resistentes a la insulina, y las personas delgadas también pueden exhibir un estado resistente a la insulina con un mayor riesgo de DM2 y ECV.La relación entre el aumento generalizado de la adiposidad y la sensibilidad a la insulina indica que solo el 11% de la variabilidad individual en la sensibilidad a la insulina puede explicarse por el IMC. Sin embargo, si el aumento de peso ocurre en un contexto resistente a la insulina, hay una acumulación asimétrica de grasa que favorece el depósito intraabdominal, y la inflamación del tejido adiposo con la entrada de macrófagos y anormalidades en las adipocinas circulantes.
Un mayor aumento de peso puede empeorar la resistencia a la insulina e intensificar la inflamación, el estrés oxidativo y la intolerancia a la glucosa. Por lo tanto, en muchas personas, pero no en todas, existe una interacción entre el exceso de adiposidad y la resistencia a la insulina que aumenta el riesgo de ECV.
La distribución anormal de la adiposidad refleja un desequilibrio de la ingesta calórica y el gasto de energía con una amplia variabilidad individual basada en factores primarios.
El aumento del tejido adiposo subcutáneo gluteofemoral está asociado con el atrapamiento de ácidos grasos libres (FFA, por su sigla en inglés), lo que disminuye la captación ectópica de FFA, los marcadores de resistencia a la insulina, la inflamación y el riesgo de ECV. De hecho, la grasa subcutánea de la pierna y el muslo -pero no del brazo-, ejercen importantes efectos cardiometabólicos protectores.
El tejido adiposo subcutáneo representa aproximadamente el 80% del tejido adiposo total y contribuye con la mayor cantidad de FFA al hígado. Debido a que el tejido adiposo disfuncional no puede acomodar adecuadamente el almacenamiento de combustible en el contexto de una ingesta calórica excesiva, los niveles de FFA aumentan y los lípidos ectópicos se acumulan en los tejidos que normalmente tienen poco o ningún almacenamiento de grasa.
Estos sitios ectópicos de almacenamiento de grasa incluyen:
- músculo esquelético
- hígado
- epicardio (entre la pared externa del miocardio y la capa visceral del pericardio)
- pericardio (entre las capas visceral y parietal del pericardio)
- intestinos
- riñones
- páncreas
Ante la pérdida de peso después de la intervención en el estilo de vida, las múltiples respuestas desadaptativas en las hormonas de saciedad, el gasto de energía y los factores psicológicos pueden hacer que el peso vuelva a niveles previamente altos de IMC.
> Efectos de la adiposidad sobre la resistencia a la insulina.
La grasa ectópica contribuye a la resistencia a la insulina.La grasa intrahepática, una forma de grasa ectópica, está asociada con un aumento de los factores de riesgo cardiometabólico y ECV. Sin embargo, hay mucho que aprender sobre el valor predictivo de la grasa ectópica y más específicamente de la enfermedad del hígado graso no alcohólico en ABCD y CMBCD.
Los pacientes con IMC en el rango de sobrepeso u obesidad pueden ser sensibles a la insulina y no tener un mayor riesgo de DM2 y/o ECV. A veces se hace referencia a estos pacientes como "obesos metabólicamente sanos".
La asociación fisiopatológica y epidemiológica de un IMC levemente aumentado con menores riesgos y un mejor pronóstico para ciertas enfermedades crónicas, incluida la ECV, se conoce como "la paradoja de la obesidad" y puede ser el resultado de una causalidad inversa.
> Efectos de la adiposidad sobre la disfunción de la célula β. En un modelo murino, el estado fisiopatológico obeso está asociado con la expansión local de los macrófagos en los islotes de Langerhans, que afectan la función de las células B.
Otra explicación implica la autofagia anormal, que interrumpe la función de las células B y, por lo tanto, en el contexto de la resistencia a la insulina relacionada con ABCD, prepara el escenario para la hiperglucemia y la progresión a prediabetes y diabetes tipo 2.
Estos y otros mecanismos conectan la obesidad, el consumo excesivo de calorías y la resistencia a la insulina con el agotamiento de las células B. Cada una de estas vías es un objetivo candidato para detener la progresión de ABCD a resistencia a la insulina.
> Efectos de la adiposidad en la ECV. Además de las vías donde la cantidad de adiposidad induce resistencia a la insulina, también hay vías donde la distribución anormal de la adiposidad, particularmente entre diferentes etnias, se asocia con un mayor riesgo y mortalidad por ECV.
La asociación del tejido adiposo epicárdico con la ECV fue más pronunciada en las mujeres, y un incidental aumento del riesgo cardiometabólico fue asociado con los cambios de adiposidad subyacentes, o por los efectos directos de la grasa epicárdica en las estructuras vecinas.
Curiosamente, el tejido adiposo epicárdico y visceral se asoció positivamente con la carga aterosclerótica, mientras que el tejido adiposo subcutáneo tuvo una asociación negativa. El tejido adiposo epicárdico también se asoció con inflamación vascular y rigidez arterial, puntuación de esclerosis de la válvula aórtica, hipertrofia del ventrículo izquierdo y fibrosis / apoptosis de cardiomiocitos y apnea obstructiva del sueño.
El tejido adiposo epicárdico segrega más fosfolipasa A2 II con isquemia, lo que resulta en una mayor hidrólisis de fosfolípidos y la generación de FFA local. El aumento de la producción de FFA por el tejido adiposo epicárdico afecta la propagación del impulso nervioso y el desarrollo de arritmias.
Los pacientes con resistencia a la insulina acumulan grasa preferentemente en el compartimento intraabdominal que contiene macrófagos residentes aumentados, predominantemente M1 (activados clásicamente, proinflamatorios), produciendo factor de necrosis tumoral α, IL-6 y MCP-1, y una proporción menor de macrófagos M2 (activados alternativamente). La polarización M1 puede aumentar la resistencia a la insulina y el riesgo de ECV.
Las interacciones complejas entre los rasgos de adiposidad y síndrome metabólico pueden conducir a la miocardiopatía por obesidad.Esto puede ocurrir a través de los efectos sobre la hipoventilación, la hipertensión pulmonar y la insuficiencia ventricular derecha, así como la disminución de la resistencia vascular sistémica que conduce a un aumento del volumen sanguíneo y el gasto cardíaco, la insuficiencia ventricular derecha y luego del VI.
El entrelazamiento entre la adiposidad, la disglucemia y otros rasgos de síndrome metabólico también se centra en la dislipidemia y la HTA. Aunque el aumento de los lípidos circulantes son factores de riesgo cardiometabólico, la acumulación de grasa reflejada por la antropometría se correlaciona mejor con la prehipertensión.
2. ENFERMEDAD CRÓNICA BASADA EN DISGLUCEMIA (DBCD)
De la adiposidad anormal a la resistencia a la insulina. DBCD proporciona un marco para la intervención temprana para CMBCD. Similar al ABCD, el modelo DBCD puede ser un término de diagnóstico más preciso y accionable que la diabetes para el espectro de eventos fisiopatológicos derivados de la resistencia a la insulina, prediabetes, diabetes tipo 2 y ECV.
Disglucemia es un término general que incluye todas las formas de diabetes (en el contexto de este documento nos referiremos solo a la DM2) y prediabetes, incluidos los estados de mayor riesgo molecular de DM2, como la resistencia a la insulina.
Las manifestaciones cardinales de la resistencia a la insulina son la normoglucemia o la hiperglucemia con hiperinsulinemia.La designación DBCD ha sido adoptada por la Asociación Americana de Endocrinólogos Clínicos.
> Efecto de la resistencia a la insulina sobre la disfunción de las células B. La resistencia a la insulina en los músculos y el hígado aumenta la demanda de secreción de insulina de las células ß pancreáticas para mantener la homeostasis de la glucosa.
- Mientras las respuestas secretoras de insulina sean sostenidas, los pacientes permanecerán normoglucémicos.
- Sin embargo, eventualmente los niveles de glucosa posprandiales aumentan cuando la secreción de insulina en la fase temprana se vuelve insuficiente para las variaciones glucémicas posprandiales normales.
- Con el debilitamiento progresivo de las células ß a lo largo del tiempo, la capacidad secretora de insulina disminuye aún más, los niveles de glucosa en ayunas aumentan y, finalmente, los pacientes alcanzan los umbrales de diagnóstico para pre-diabetes y luego DM2.
La constelación de anomalías, que incluyen inflamación, agrandamiento auricular y disfunción sistólica y diastólica ventricular, se ha asociado con un mayor riesgo de fibrilación auricular.
Los efectos de la resistencia a la insulina en la biología vascular incluyen:
|
El IRAS (Estudio de Resistencia a la Insulina y Aterosclerosis) y el BIP (Ensayo de Prevención de Infarto de Bezafibrato) demostraron que la resistencia a la insulina estaba asociada con el desarrollo de eventos de ECV. Gast y col. realizaron un metaanálisis en el que se descubrió que la resistencia a la insulina se asoció significativamente con el riesgo relativo de eventos cardiovasculares.> Efecto de la resistencia a la insulina sobre la dislipidemia.
La dislipidemia asociada con la resistencia a la insulina se caracteriza por:
|
También hay un aumento de los triglicéridos grandes circulantes que contienen moléculas de lipoproteínas de muy baja densidad (VLDL) debido a una mayor producción hepática (a partir del aumento del flujo de FFA en el hígado) y un aclaramiento reducido debido a la disminución de la lipoproteína lipasa.Los altos niveles de VLDL, junto con las acciones de la proteína transportadora de ésteres de colesterol (CETP, por su sigla en inglés) y la lipasa hepática, participan en la generación de pequeñas LDL densas. CETP facilita el intercambio de ésteres de colesterol y triglicéridos entre las lipoproteínas, lo que resulta en una pérdida neta de ésteres de colesterol y ganancia de triacilgliceroles por HDL y LDL, y una ganancia neta recíproca de ésteres de colesterol y pérdida de triacilgliceroles por quilomicrones y VLDL.
La LDL rica en triglicéridos resultante se convierte en un sustrato para la acción lipolítica de la lipasa hepática que resulta en la formación de pequeñas LDL densas. La lipasa hepática también actúa sobre las HDL ricas en triglicéridos para producir pequeñas HDL densas (lo que resulta en una disminución de HDL-c) que son susceptibles a un mayor catabolismo.
El aumento de la concentración de partículas pequeñas y densas de LDL es un factor de riesgo para ECV, independiente de los niveles generales de LDL-c.El estudio ARIC (Riesgo de Aterosclerosis en las Comunidades) demostró prospectivamente que los niveles plasmáticos de LDL densa y pequeña eran predictivos de ECV de forma independiente. Al ingresar a la pared vascular, los macrófagos absorben preferentemente partículas de LDL modificadas, lo que conduce a la acumulación de colesterol, la formación de células espumosas y la inducción de inflamación.
Por lo tanto, los cambios en los lípidos y las lipoproteínas que se producen únicamente en función de la resistencia a la insulina son aterogénicos, aceleran la aterosclerosis independientemente del LDL-c general y comienzan temprano en el curso de CMBCD.
> Efecto de la resistencia a la insulina sobre la disfunción endotelial. La resistencia a la insulina se correlaciona con la disfunción endotelial incluso en pacientes sin diabetes.
La insulina en el endotelio regula la actividad de eNOS y la producción del vasodilatador NO. Con la resistencia a la insulina, esta vía se inhibe, mientras que la vía de señalización de la proteína mitogénica MAPK no presenta obstáculos y es hiperactiva debido a la hiperinsulinemia.
La señalización de MAPK aumenta la producción del vasoconstrictor endotelina-1, de modo que el efecto neto del desequilibrio entre las vías de señalización de insulina metabólicas y mitogénicas es la vasoconstricción. La vía mitogénica también promueve la proliferación de células del músculo liso vascular y la expresión de la proteína de adhesión celular vascular (VCAM) -1 y E-selectina.
Además, la resistencia a la insulina se asocia con una mayor actividad del sistema nervioso simpático y el sistema renina-angiotensina-aldosterona (RAAS).Las combinaciones de estos procesos que afectan la pared vascular mejoran la vasoreactividad y explican la relación entre la resistencia a la insulina, la presión arterial elevada, el desarrollo de HTA y la progresión en el tiempo a ECV.
Además, el estado resistente a la insulina se caracteriza por una diátesis de coagulación debido a disfunción endotelial, resistencia a la insulina y disminución de la producción de NO, lo que aumenta la adhesividad plaquetaria, junto con un aumento de la producción de inhibidor del activador de fibrinógeno y plasminógeno circulante 1 (PAI-1) por el tejido adiposo.
> Efecto de la resistencia a la insulina sobre la inflamación. Una condición sine qua non de la resistencia a la insulina es el tejido adiposo inflamado que aumenta la liberación de citocinas proinflamatorias. Estas citocinas y otros factores circulantes, como las lipoproteínas oxidadas y ricas en triglicéridos, se suman a los efectos locales de la lipotoxicidad, la glucotoxicidad y el estrés oxidativo para aumentar la inflamación de la pared vascular.
Estos factores aumentan la expresión de la molécula de adhesión celular que promueve el margen de monocitos, la absorción, la conversión en macrófagos y la ávida acumulación de colesterol, particularmente en forma de LDL modificada. Las partículas de lipoproteína son proinflamatorias e inducen una respuesta inmune que forma complejos inmunes que contienen LDL que agravan su aterogenicidad.
Los macrófagos residentes en la pared vascular absorben fácilmente las partículas de LDL modificadas y se convierten en células espumosas, lo que conduce a la formación de estrías grasas y al desarrollo de la placa.
Los macrófagos juegan un papel esencial en todas las etapas de la progresión de la lesión aterosclerótica. Los macrófagos M1 secretan factores proinflamatorios, como así también altos niveles de ROS. Por el contrario, los macrófagos M2 secretan factores antiinflamatorios.
Con resistencia a la insulina, los macrófagos M1 residentes aumentan en la pared vascular y el tejido adiposo. Aunque ambos fenotipos de macrófagos se detectan en lesiones ateroscleróticas, los macrófagos M1 proinflamatorios se enriquecen en placas progresivas, donde juegan un papel crítico en la aterogénesis, y los macrófagos M2 están presentes en placas en regresión.
> Efecto de la resistencia a la insulina sobre el metabolismo cardíaco. Con el estado de resistencia a la insulina, los mismos procesos que deterioran la acción de la insulina en el músculo esquelético también ocurren en el miocardio. Hay una acumulación aumentada de lípidos ectópicos en el cardiomiocito, lo que resulta en lipotoxicidad miocárdica, frente a mayores niveles de FFA en suero.
El diacilglicerol intracelular, los factores inflamatorios, la disfunción mitocondrial y el estrés oxidativo activan las serina quinasas que fosforilan y deterioran la señalización de la insulina a través del receptor de insulina y el IRS-1, y también activan las vías NFkB que pueden amplificar la inflamación de los miocitos. Estos eventos coordinados reducen la capacidad de la insulina para estimular la absorción de glucosa y la oxidación en el corazón.
El miocardio utiliza ácidos grasos como su opción preferida de combustible, excepto en presencia de estimulación o isquemia cuando el corazón depende de la glucosa como combustible. Debido a defectos en la acción de la insulina y la función mitocondrial, esta flexibilidad para convertirse al metabolismo de la glucosa se ve afectada. Las alteraciones metabólicas en la utilización del sustrato, combinadas con la activación inapropiada del RAAS, la disfunción endotelial, la activación del sistema nervioso simpático, el estrés oxidativo y la inflamación, producen anomalías estructurales en el corazón.
La lesión celular y las anormalidades en las proteínas contráctiles promueven la fibrosis intersticial del tejido cardíaco, y la rigidez cardíaca deteriora la relajación de la diástole y el llenado del ventrículo antes de la sístole.
El resultado es la insuificiencia cardíaca (IC) con fracción de eyección preservada acompañada de un aumento del tamaño de la aurícula izquierda, masa del VI y desarrollo de disfunción diastólica. Con el tiempo, la disfunción diastólica puede progresar a disfunción sistólica e IC con fracción de eyección reducida.
> Pre-diabetes a CVD. El riesgo cardiovascular se asocia de manera concluyente con pre-diabetes, síndrome metabólico y DM2. El control del factor de riesgo multifactorial conduce a una reducción duradera en el número de eventos de CVD y mortalidad, incluso en pacientes con T2D.
La hiperglucemia altera el transporte de glucosa estimulada por insulina debido a los efectos directos sobre las células objetivo. La hiperglucemia también aumenta directamente el estrés oxidativo y las vías inflamatorias. Los productos finales de glicación avanzada (PFGA) aumentan con la DM2, debido a la exposición prolongada de proteínas y lípidos a la hiperglucemia, y contribuyen a lesiones oxidativas y complicaciones CV.
Hay más fibrosis y rigidez miocárdica debido a la formación de PFGA y la reticulación de colágeno. La dislipidemia de la resistencia a la insulina y la modificación de las lipoproteínas por oxidación o PFGA se ven agravadas por la hiperglucemia.
> Diabetes tipo 2 a ECV. La asociación del aumento del riesgo de ECV en pacientes con DM2 está bien establecida.
En pacientes con DM2 en Dinamarca, los riesgos de ECV fueron mayores que aquellos con diabetes tipo 1 o diabetes autoinmune latente en adultos. Entre aquellos con T2D, la variabilidad glucémica y la hipoglucemia se correlacionan con aterosclerosis y complicaciones macrovasculares, posiblemente debido a efectos sobre la inflamación.
El riesgo de hospitalización por IC también es mayor con DM2, aunque disminuye con la edad avanzada (> 75 años) y el objetivo A1C (<7%), o sin albuminuria.
En pacientes con DM2, la disfunción miocárdica y la insuficiencia cardíaca se desarrollan a una edad más temprana, ocurren con mayor frecuencia y ejercen una mayor morbilidad debido a las interacciones entre la señalización de la insulina, la utilización de glucosa alterada, la inflamación, el estrés oxidativo y la disfunción endotelial.
Conclusiones
|
Contenidos relacionados
Los editores le recomiendan continuar con las siguientes lecturas:
































No hay comentarios:
Publicar un comentario