
Una enfermedad multisistémica | 19 JUL 20
Manifestaciones extrapulmonares de COVID-19
La fisiopatología y el impacto clínico de COVID-19 en varios sistemas de órganos
Autor/a: A. Gupta, M. Madhavan, K. Sehgal y colaboradores Fuente: Nat Med (2020) Extrapulmonary manifestations of COVID-19
Introducción
Si bien se sabe que el SARS-CoV-2 causa una enfermedad pulmonar sustancial, incluida la neumonía y el síndrome de dificultad respiratoria aguda (SDRA), los médicos han observado muchas manifestaciones extrapulmonares de COVID-19.
Esto puede reflejar la diseminación y la replicación extrapulmonar del SARS-CoV-2, como se ha observado para otros coronavirus zoonóticos. Para proporcionar una perspectiva sobre estas manifestaciones extrapulmonares, se discute aquí la fisiopatología y el impacto clínico de COVID-19 en varios sistemas de órganos.
Fisiopatología
El SARS-CoV-2 parece emplear mecanismos para el reconocimiento de receptores similares a los utilizados por los coronavirus virulentos anteriores como el SARS-CoV, el patógeno responsable de la epidemia de SARS de 2003. La subunidad de espiga de SARS-CoV y la de SARS CoV-2 comprometen a ACE2 (enzima convertidora de angiotensina 2) como receptor de entrada. Además, la entrada celular requiere el cebado de la proteína espiga por la serina proteasa celular TMPRSS2 u otras proteasas.
Se requiere la coexpresión en la superficie celular de ACE2 y TMPRSS2 para completar este proceso de entrada. Estudios recientes han demostrado una mayor afinidad de unión de SARS-CoV-2 a ACE2 que de SARS-CoV a ACE2, lo que puede explicar parcialmente la mayor transmisibilidad de SARS-CoV-2.
Si bien algunos de estos mecanismos, incluida la entrada viral mediada por ACE2 y el daño tisular, y la desregulación del SRAA, pueden ser exclusivos de COVID-19, la patogenia inmune causada por la liberación sistémica de citocinas y las disfunciones de microcirculación también pueden ocurrir secundarias a la sepsis.
Toxicidad viral directa
Estudios han aislado ARN viral de muestras fecales con títulos altos y, con menos frecuencia, de orina y sangre. Los estudios histopatológicos han informado de organotropismo del SARS-CoV-2 más allá del tracto respiratorio, incluido el tropismo a los tejidos renal, miocárdico, neurológico, faríngeo y gastrointestinal.
Estos hallazgos sugieren que la lesión de múltiples órganos puede ocurrir al menos en parte debido al daño directo viral del tejido. El mecanismo de diseminación extrapulmonar del SARS-CoV-2, ya sea hematógeno o no, sigue siendo difícil de dilucidar.
Daño de células endoteliales y tromboinflamación
El daño de las células endoteliales en virtud de la entrada mediada por ACE2 del SARS-CoV-2 y la inflamación posterior y la generación de un entorno protrombótico son otros mecanismos fisiopatológicos propuestos de COVID-19.
La expresión de ACE2 se ha demostrado en el endotelio arterial y venoso de varios órganos, y los estudios histopatológicos han encontrado evidencia microscópica de partículas virales de SARS-CoV-2 en las células endoteliales de los riñones y los pulmones.
La lesión endotelial mediada por infección (caracterizada por niveles elevados de factor von Willebrand) y endotelitis (marcada por la presencia de neutrófilos y macrófagos activados), que se encuentran en múltiples lechos vasculares (incluidos los pulmones, los riñones, el corazón, el intestino delgado y el hígado) en los pacientes con COVID-19 pueden desencadenar la producción excesiva de trombina, inhibir la fibrinólisis y activar las vías del complemento, iniciar la tromboinflamación y finalmente conducir al depósito de microtrombos y la disfunción microvascular.
La comunicación cruzada entre plaquetas y neutrófilos y la activación de macrófagos en este contexto pueden facilitar una variedad de efectos proinflamatorios, como la liberación de citocinas, la formación de trampas extracelulares de neutrófilos (NETs) y la formación de fibrina y / o microtrombos.
Las NETs dañan aún más el endotelio y activan tanto las vías de coagulación extrínsecas como las vías de coagulación intrínsecas. Finalmente, los efectos directos mediados por el coronavirus también pueden conducir a un desequilibrio de las vías pro y anticoagulantes.
Desregulación de la respuesta inmune
La respuesta inmune desregulada y el síndrome de liberación de citoquinas, debido a la hiperactivación de la inmunidad innata en el contexto de la linfodepleción de células T, caracterizan las presentaciones de COVID-19 grave.
La elevación de los marcadores inflamatorios séricos, como la proteína C reactiva, la ferritina, la velocidad de sedimentación globular, el dímero D, el fibrinógeno y la lactato deshidrogenasa es predictiva de la enfermedad crítica y mortalidad posterior en pacientes con COVID-19. Los niveles más altos de la citocina IL-6 en el suero también se han relacionado con un peor pronóstico y se ha encontrado que se correlacionan con los niveles de fibrinógeno en pacientes con COVID-19.
Desregulación del SRAA
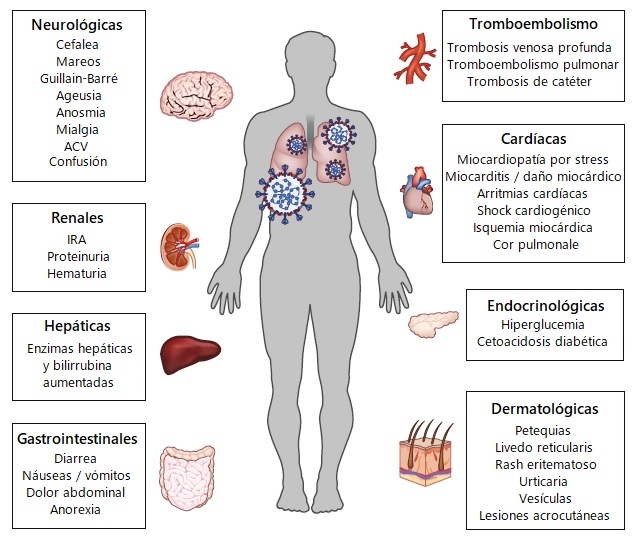
• Manifestaciones hematológicas
Los pacientes con COVID-19 pueden presentar varias anomalías de laboratorio y complicaciones tromboembólicas.
Epidemiología y presentación clínica
La linfopenia, un marcador de inmunidad celular alterada, es un hallazgo cardinal de laboratorio reportado en 67 a 90% de los pacientes con COVID-19, con asociación pronóstica en la gran mayoría de los estudios publicados. Se han revelado disminuciones tanto en las células T CD4 + como en las células T CD8 + asociadas en pacientes con COVID-19 grave.
Además, la leucocitosis (especialmente la neutrofilia), que se observa con menos frecuencia, también es un marcador pronóstico negativo. La trombocitopenia, aunque a menudo es leve (en 5 a 36% de los ingresos), se asocia con peores resultados del paciente.
La coagulopatía asociada a COVID-19 está marcada por niveles elevados de dímero D y fibrinógeno, con anormalidades menores en el tiempo de protrombina, tiempo de tromboplastina parcial activada y recuentos de plaquetas en la etapa inicial de la infección. Los niveles elevados de dímero D al ingreso y un aumento longitudinal durante la hospitalización se han relacionado con una peor mortalidad en COVID-19.
Fisiopatología
Los posibles mecanismos propuestos por los cuales ocurre la linfopenia incluyen la acción citotóxica directa del virus relacionado con la entrada dependiente o independiente de ACE2 en los linfocitos, el agotamiento de linfocitos mediado por apoptosis y los efectos inhibitorios del ácido láctico sobre la proliferación de linfocitos. Además, se han descrito atrofia del bazo y la destrucción generalizada de los tejidos linfoides.
Se cree que la leucocitosis (especialmente la neutrofilia) es una consecuencia de una respuesta hiperinflamatoria a la infección por SARS-CoV-2 y / o infecciones bacterianas secundarias. Los niveles anormalmente altos de dímero D y fibrinógeno en la sangre durante las primeras etapas de la infección reflejan una inflamación excesiva en lugar de una coagulación intravascular diseminada manifiesta, que comúnmente se observa solo en las etapas posteriores de COVID-19.
El aumento de la expresión de ACE2 en las células endoteliales después de la infección con SARS-CoV-2 puede perpetuar un círculo vicioso de endotelitis que promueve la inflamación tromboinflamatoria. Colectivamente, los cambios hemostáticos e inflamatorios, que reflejan el daño y la activación endoteliales, así como la enfermedad crítica, constituyen un entorno protrombótico.
Consideraciones de manejo
Un análisis retrospectivo encontró tasas más bajas de mortalidad hospitalaria en pacientes con COVID-19 que recibieron anticoagulación terapéutica. Los anticoagulantes parenterales (como la heparina de bajo peso molecular o no fraccionada) se prefieren a los anticoagulantes orales en el entorno hospitalario, dada su corta vida media y la disponibilidad inmediata de agentes de reversión, debido a la posibilidad de interacciones farmacológicas cuando se están tomado con tratamientos antivirales (como ritonavir) y tratamientos antibacterianos (como azitromicina).
• Manifestaciones cardiovasculares
Se han informado varias presentaciones cardiovasculares de COVID-19.
Epidemiología y presentación clínica
El SARS-CoV-2 puede causar secuelas cardiovasculares directas y secuelas cardiovasculares indirectas, incluyendo lesiones miocárdicas, síndromes coronarios agudos (SCA), cardiomiopatía, cor pulmonale agudo, arritmias y shock cardiogénico, así como las complicaciones trombóticas mencionadas anteriormente.
La lesión miocárdica, con elevación de los biomarcadores cardíacos se produjo en el 20-30% de los pacientes hospitalizados con COVID-19, con tasas más altas (55%) entre aquellos con enfermedad cardiovascular preexistente. Una mayor frecuencia y magnitud de las elevaciones de troponina en pacientes hospitalizados se asocia con una enfermedad más grave y peores resultados. Se ha informado de miocardiopatía biventricular en 7 a 33% de los pacientes críticos con COVID-19.
También se ha informado insuficiencia ventricular derecha aislada con y sin embolia pulmonar confirmada. Las arritmias cardíacas, incluidas la fibrilación auricular de inicio reciente, el bloqueo cardíaco y las arritmias ventriculares, también son frecuentes, y ocurren en el 17% de los pacientes hospitalizados y el 44% de los pacientes.
Los informes de Lombardía, Italia, muestran un aumento de casi el 60% en la tasa de paro cardíaco extrahospitalario durante la pandemia de COVID-19 de 2020 en relación con un período de tiempo similar en 2019, lo que sugiere que la etiología sea COVID-19 u otra patología no tratada debido a la renuencia de los pacientes a buscar atención.
Fisiopatología
La fisiopatología subyacente a las manifestaciones cardiovasculares es probablemente multifactorial. ACE2 tiene una alta expresión en el tejido cardiovascular, incluidos miocitos cardíacos, fibroblastos, células endoteliales y células de músculo liso, en apoyo de un posible mecanismo de lesión viral directa.
La miocarditis es una presunta etiología de la disfunción cardíaca, y el desarrollo de la miocarditis puede estar relacionado con la carga viral. Mientras que el aislamiento del virus del tejido miocárdico se ha informado en algunos estudios de autopsia, otros informes patológicos han descrito infiltrados inflamatorios sin evidencia miocárdica de SARS-CoV-2.
El síndrome de respuesta inflamatoria sistémica (tormenta de citoquinas) es otro supuesto mecanismo de lesión miocárdica. Además, los pacientes con enfermedad cardiovascular preexistente pueden tener niveles más altos de ACE2, lo que podría predisponerlos a COVID-19 más grave.
La disfunción ventricular derecha aislada puede ocurrir como resultado de presiones vasculares pulmonares elevadas secundarias a SDRA, tromboembolismo pulmonar o lesión potencialmente mediada por virus en el tejido vascular endotelial y del músculo liso.
Otras posibles etiologías de daño miocárdico no específicas de COVID-19 incluyen isquemia severa o infarto de miocardio en pacientes con enfermedad coronaria preexistente, disfunción miocárdica mediada por estrés, miocardiopatía inducida por taquicardia y aturdimiento miocárdico después de reanimación o hipotensión prolongada.
Si bien los pacientes con infecciones virales corren el riesgo de infarto de miocardio en general, este riesgo puede ser exagerado en pacientes con COVID-19, dados los informes de hipercoagulabilidad desproporcionadamente aumentada en las personas afectadas, lo que llevaría a un posible aumento en el IM mediado trombóticamente.
Consideraciones de manejo
Si la regulación positiva de ACE2 por los inhibidores de la ECA (IECA) o los bloqueadores de los receptores de angiotensina (ARA) protege los pulmones o aumenta la susceptibilidad a la infección por SARS-CoV-2, se ha debatido intensamente.
Esto tiene implicancias para los pacientes con hipertensión, insuficiencia cardíaca y / o diabetes, que están sobrerrepresentados entre los pacientes críticos con COVID-19. No hay evidencia que respalde una asociación entre el uso de IECA y ARA y enfermedad más grave.
Además, la ecocardiografía en el punto de atención se puede usar para evaluar las anomalías para guiar las decisiones sobre el cateterismo cardíaco. Los procedimientos menos urgentes o electivos se deben diferir para minimizar el riesgo de transmisión viral. El intervalo QTc basal del paciente debe obtenerse antes de la administración de cualquier medicamento que pueda conducir a la prolongación de este intervalo.
• Manifestaciones renales
Una proporción sustancial de pacientes con COVID-19 grave puede mostrar signos de daño renal.
Epidemiología y presentación clínica
La lesión renal aguda (IRA) es una complicación frecuente de COVID-19 y está asociada con la mortalidad. En un estudio de casi 5.500 pacientes de Nueva York, la IRA ocurrió en el 37%, y el 14% de los pacientes requirió diálisis. La IRA se produjo a tasas mucho más altas en pacientes críticos, entre un 78% y 90%. Además, se ha informado hematuria en casi la mitad de los pacientes con COVID-19, y se ha informado de proteinuria en hasta el 87% de los pacientes críticos con COVID-19.
La hipercalemia y la acidosis son anormalidades electrolíticas comunes asociadas con la alta renovación celular observada en pacientes con COVID-19, incluso entre pacientes sin IRA. COVID-19 también se informa cada vez más entre pacientes con enfermedad renal en etapa terminal y receptores de trasplante de riñón, con tasas de mortalidad más altas que las observadas en la población general.
Fisiopatología
Cabe destacar varios posibles mecanismos.
El análisis de orina y el cociente proteinuria-creatininuria se pueden obtener al ingreso para pacientes con COVID-19, ya que la proteinuria y la hematuria parecen estar asociadas con un curso clínico más severo y una mortalidad más alta, y esto brindaría una oportunidad para la estratificación temprana del riesgo.
Se debe poner énfasis en la optimización de la volemia para prevenir la IRA prerrenal, particularmente dada la alta prevalencia de IRA, evitando la hipervolemia que puede empeorar el estado respiratorio del paciente.
Las pautas recomiendan una estrategia conservadora de reanimación con líquidos al tiempo que reconocen que la base de evidencia de apoyo es débil. Un aumento dramático en la necesidad de TRR en pacientes críticos puede requerir una planificación juiciosa de los recursos.
El estado protrombótico plantea desafíos adicionales en el inicio y mantenimiento de los circuitos extracorpóreos necesarios para la TRR. En ausencia de contraindicaciones, los pacientes con COVID-19 pueden requerir anticoagulación sistémica durante la TRR.
• Manifestaciones gastrointestinales
COVID-19 puede causar síntomas gastrointestinales en algunos pacientes.
Epidemiología y presentación clínica
La incidencia de manifestaciones gastrointestinales ha oscilado entre 12% y 61%. Los síntomas gastrointestinales pueden estar asociados con una mayor duración de la enfermedad, pero no se han asociado con una mayor mortalidad.
En un metaanálisis reciente se informó la prevalencia combinada de síntomas individuales, incluida la anorexia (21%), náuseas y / o vómitos (7%), diarrea (9 %) y dolor abdominal (3%). En un estudio de los EE. UU., se informó una mayor prevalencia de estos síntomas.
Fisiopatología
La fisiopatología del daño gastrointestinal en COVID-19 es probablemente multifactorial. El daño tisular directo mediado por virus es plausible, dada la presencia de ACE2 en las células glandulares intestinales, así como la visualización de la proteína nucleocápside viral en las células epiteliales gástricas, duodenales y rectales, y los enterocitos glandulares.
El ARN viral se ha aislado de las heces, con una tasa de positividad del 54%. Se ha informado de la eliminación viral de viriones infecciosos en materia fecal incluso después de la resolución de los síntomas. Además, la evidencia histopatológica sugiere una lesión microvascular del intestino delgado.
La presencia de células plasmáticas y linfocitos infiltrantes y de edema intersticial en la lámina propia del estómago, el duodeno y el recto de los pacientes apoya el daño tisular mediado por la inflamación. También se ha planteado la hipótesis de que la alteración de la flora intestinal por el virus puede contribuir a los síntomas gastrointestinales y la progresión grave de la enfermedad.
Consideraciones de manejo
Las pautas actuales de múltiples sociedades enfatizan evitar de la endoscopia diagnóstica por razones no urgentes durante la pandemia de COVID-19. Se ha informado que los pacientes que presentan síntomas gastrointestinales y luego dan positivo por SARS-CoV-2 presentan retrasos en el diagnóstico.
Cuando sea factible, COVID-19 debe considerarse como un diagnóstico diferencial en estos pacientes, incluso en ausencia de síntomas respiratorios. En entornos con recursos limitados, los pacientes con síntomas de diarrea o náuseas y / o vómitos además de síntomas respiratorios deben tener prioridad para el testeo.
• Manifestaciones hepatobiliares
Se pueden observar signos de daño hepatobiliar en pacientes con presentaciones graves de COVID-19.
Epidemiología y presentación clínica
En pacientes críticos con COVID-19, se observa un patrón de lesión hepatocelular en 14-53% de los pacientes hospitalizados. Las aminotransferasas son típicamente elevadas, pero permanecen menos de cinco veces el límite superior de lo normal.
Una revisión sistemática reciente informó una prevalencia combinada de anormalidades de la función hepática del 19% con una asociación con la gravedad de la enfermedad. La bilirrubina elevada al ingreso hospitalario también se ha relacionado con la gravedad de la enfermedad y la progresión a enfermedad crítica en algunos estudios.
Fisiopatología
El SARS-CoV-2 puede dañar directamente los conductos biliares al unirse a ACE2 en los colangiocitos. La hiperinflamación observada con la tormenta de citoquinas y los trastornos metabólicos asociados con la hipoxia son otros mecanismos potenciales de daño hepático. También puede producirse una lesión hepática inducida por fármacos, particularmente secundaria a agentes en investigación como remdesivir, lopinavir y tocilizumab.
Otros cambios histopatológicos en el hígado incluyeron esteatosis hepática, fibrosis portal, infiltrados linfocíticos y proliferación ductular, colestasis lobular y necrosis aguda de células hepáticas, junto con trombosis de vena central.
Consideraciones de manejo
No se recomiendan pruebas de diagnóstico adicionales para elevaciones de aminotransferasas a menos que características adicionales aumenten la probabilidad de hallazgos que requieran medidas adicionales (como hiperbilirrubinemia, dolor de cuadrante superior derecho y hepatomegalia).
Se deben considerar otras etiologías relacionadas con COVID-19 de bioquímicas hepáticas elevadas, como miositis, lesión cardíaca (junto con elevación de troponina), isquemia, síndrome de liberación de citocinas y coinfección con otros virus. Se recomienda la monitorización longitudinal de las transaminasas hepáticas, particularmente en pacientes que reciben tratamientos en investigación.
• Manifestaciones endocrinológicas
Mientras que los pacientes con trastornos endocrinológicos preexistentes pueden estar predispuestos a presentaciones más graves de COVID-19, también se han realizado observaciones de una variedad de manifestaciones endocrinológicas en pacientes sin enfermedad preexistente.
Epidemiología y manifestaciones clínicas
Los pacientes con diabetes mellitus y / u obesidad corren el riesgo de desarrollar una enfermedad COVID-19 más grave. En un informe de los CDCs de EE. UU., el 24% de los pacientes hospitalizados y el 32% de los pacientes ingresados en la UCI tenían diabetes subyacente.
Estudios de China e Italia demostraron una asociación de diabetes subyacente con enfermedad grave y muerte. Además, los pacientes hospitalizados con COVID-19 han exhibido una variedad de anormalidades en el metabolismo de la glucosa, incluyendo hiperglucemia empeorada, cetosis euglucémica y cetoacidosis diabética clásica.
En un estudio retrospectivo de China, entre un grupo de 658 pacientes hospitalizados con COVID-19, el 6,4% presentó cetosis en ausencia de fiebre o diarrea. De estos, el 64% no tenía diabetes subyacente (con un nivel promedio de hemoglobina A1c del 5,6% en este grupo).
Fisiopatología
Los factores relacionados con el SARS-CoV-2 incluyen niveles de citocinas sustancialmente elevados, lo que puede conducir a alteraciones en la función de las células β pancreáticas y su apoptosis y, en consecuencia, a una disminución de la producción de insulina y cetosis. La expresión de ACE2 se ha informado en el páncreas endocrino, aunque de manera inconsistente.
Esto plantea la posibilidad de que la unión directa de SARS-CoV-2 a ACE2 en las células β pueda contribuir a la deficiencia de insulina y la hiperglucemia, como se ha demostrado previamente para la infección con SARS-CoV. Otros factores no específicos incluyen una respuesta inmune alterada y un aumento en las hormonas contrarreguladoras que promueven la producción de glucosa hepática, disminución de la secreción de insulina, cetogénesis y resistencia a la insulina.
Las manifestaciones extrapulmonares clave de COVID-19 también pueden estar relacionadas con complicaciones diabéticas, desde la función renal reducida hasta los estados pro-trombóticos y coagulopáticos, hasta la disfunción cardíaca y la lesión de los hepatocitos.
Consideraciones de manejo
La HbA1C debe evaluarse en pacientes con COVID-19 que presenten hiperglucemia y / o cetoacidosis, para identificar diabetes posiblemente no diagnosticada. El manejo de la cetoacidosis diabética plantea un mayor riesgo para el personal médico, debido a la necesidad de controles de glucosa por hora mientras los pacientes reciben goteo de insulina.
Puede haber una función para el monitoreo remoto de glucosa a través de monitores continuos de glucosa para aliviar este problema y reducir las demandas del personal de enfermería. Los protocolos alternativos para insulina subcutánea en grupos seleccionados de pacientes con cetoacidosis diabética de leve a moderada se pueden considerar individualmente.
• Manifestaciones neurológicas y oftalmológicas
Hay evidencia creciente de complicaciones neurológicas de COVID-19
Epidemiología y presentación clínica
Se han descrito múltiples manifestaciones neurológicas de COVID-19. Un análisis de 214 pacientes con COVID-19 grave encontró que los síntomas neurológicos ocurrieron en el 36% de los pacientes.
Una serie de síntomas neurológicos leves inespecíficos son notables en pacientes hospitalizados con COVID-19, incluyendo dolor de cabeza (8–42%), mareos (12%), mialgia y / o fatiga (11–44%), anorexia (40%), anosmia (5%) y ageusia (5%), aunque la epidemiología puede ser diferente en presentaciones ambulatorias más leves.
Las presentaciones más graves de COVID-19 se manifiestan con accidente cerebrovascular agudo (hasta en el 6% de las personas con enfermedad grave) y confusión o alteración de la conciencia (8–9%). El síndrome de Guillain-Barré también se ha informado en algunos pacientes.
Además, se han descrito meningoencefalitis, síndrome de encefalopatía posterior reversible hemorrágica y encefalopatía necrotizante aguda. También se han notificado manifestaciones oculares, como congestión conjuntival sola, conjuntivitis y cambios en la retina.
Fisiopatología
Otros coronavirus tienen capacidades neuroinvasivas y neurotrópicas conocidas. La invasión viral directa del parénquima neural es una posibilidad; el SARS-CoV-2 puede acceder al sistema nervioso central a través de la mucosa nasal, la lámina cribosa y el bulbo olfatorio o por transporte axonal retrógrado.
Las células epiteliales nasales muestran la expresión más alta de ACE2 en el árbol respiratorio; esto puede explicar los síntomas de alteración del sentido del gusto o del olfato, frecuentemente reportados retrospectivamente en la mayoría de los pacientes.
Otras manifestaciones neurológicas apoyan, al menos, la neurovirulencia de COVID-19, tal vez reflejando la cascada proinflamatoria y protrombótica a raíz de la tormenta de citocinas, ya que afecta la vasculatura cerebral y la barrera hematoencefálica.
Consideraciones de manejo
Las pautas exigen el cumplimiento continuo de las recomendaciones establecidas para el accidente cerebrovascular isquémico agudo, incluido el acceso a la trombolisis y la trombectomía, al tiempo que se reconoce la necesidad de minimizar el uso de equipos de protección personal. Las pautas de monitoreo de la atención post-aguda pueden ajustarse para las restricciones pandémicas.
También se recomienda el uso del 'telestroke' o evaluación remota de pacientes que han sufrido un derrame cerebral. Se están investigando consideraciones a largo plazo, como el compromiso neurodegenerativo y neuroinflamatorio posinfeccioso, así como la eficacia de una vacuna eventual en algunas poblaciones inmunodeprimidas.
• Manifestaciones dermatológicas
En ocasiones, se han descrito manifestaciones dermatológicas en pacientes que padecen COVID-19.
Epidemiología y presentación clínica
En un estudio observacional en Italia, aproximadamente el 44% de los pacientes tenían hallazgos cutáneos al inicio de la enfermedad, mientras que los pacientes restantes los desarrollaron durante el curso de su enfermedad.
No se observó correlación con la gravedad de la enfermedad en este pequeño estudio. Las manifestaciones cutáneas incluyeron erupción eritematosa, urticaria y vesículas similares a la varicela. Una revisión sistemática de 46 estudios encontró que las lesiones acrocutáneas (pernio o tipo sabañones) son la manifestación cutánea más comúnmente informada, asociadas con COVID-19 menos grave.
Otros hallazgos cutáneos incluyeron lesiones livedoides y / o necróticas, observadas en COVID-19 más grave. Los informes de casos también han descrito erupciones exantematosas y petequias.
Fisiopatología
La exposición a fármacos y la asociación temporal con hidroxicloroquina, remdesivir, tocilizumab y otros fármacos experimentales siempre deben evaluarse antes de que cualquier lesión cutánea se atribuya a la infección viral.
Los mecanismos potenciales para las manifestaciones cutáneas relacionadas con COVID-19 incluyen una respuesta de hipersensibilidad inmune al ARN del SARS-CoV-2, el síndrome de liberación de citocinas, el depósito de microtrombos y la vasculitis. En ocasiones se han visto pequeños trombos en los vasos de la dermis.
Consideraciones de manejo
La mayoría de las manifestaciones cutáneas de COVID-19 se han resuelto por sí mismas. No se entiende claramente si los pacientes con enfermedades dermatológicas que reciben terapias biológicas tienen un mayor riesgo de complicaciones por COVID-19.
La Academia Estadounidense de Dermatología recomienda la interrupción de la terapia biológica en pacientes con COVID-19 positivo (similar a la recomendación para pacientes con otras infecciones activas) y recomienda una discusión caso por caso sobre la continuación de estos medicamentos para pacientes de riesgo.
Consideraciones especiales en COVID-19
Aquí revisamos las características epidemiológicas y clínicas de pacientes pediátricas y embarazadas con COVID-19.
Niños
Epidemiología y presentación clínica
En una revisión de 72.314 pacientes con COVID-19 informados por el CDC Chino, menos del 1% de los pacientes eran menores de 10 años de edad. En dos estudios retrospectivos, la mayoría de los pacientes tenían enfermedad leve o moderada, y solo el 1.8% requirió ingreso en la UCI, con dos muertes reportadas. En un estudio reciente de un gran grupo de UCI pediátricas de América del Norte, el 38% de los 48 niños críticos necesitaron ventilación invasiva, con una tasa de mortalidad hospitalaria del 4,2%.
En la fase posterior de la pandemia, médicos de Europa y Estados Unidos destacaron informes de niños sanos que presentaban un shock inflamatorio severo que tenía características similares a las de la enfermedad de Kawasaki atípica o el síndrome de shock tóxico.
Este síndrome se reconoció como síndrome inflamatorio multisistémico en niños (MIS-C) y se definió de la siguiente manera: una persona <21 años de edad que presenta fiebre, evidencia de laboratorio de inflamación y evidencia de enfermedad clínicamente grave que requiere hospitalización, con dos o más sistemas de órganos afectados en el contexto de infección actual o reciente con SARS-CoV-2. Si no se trata, la enfermedad de Kawasaki puede provocar aneurismas coronarios en el 25% de los pacientes.
Fisiopatología
Las posibles razones de las manifestaciones menos graves de COVID-19 en niños incluyen la evolución de la expresión de ACE2 y la inmunidad de las células T y un entorno de citocinas proinflamatorio con la edad. También se ha planteado la hipótesis de la posibilidad de competencia entre el SARS-CoV-2 y otros virus preexistentes que son comunes en la mucosa respiratoria de niños pequeños.
Por el contrario, el aumento de la expresión de ACE2 alrededor del nacimiento, antes de su disminución, y una capacidad reducida de las células T para combatir las infecciones virales al nacer pueden ser responsables de la susceptibilidad de los bebés al COVID-19 grave.
Curiosamente, muchos niños con MIS-C dieron negativo para SARS-CoV-2 pero positivo para anticuerpos, lo que sugiere un posible desencadenante del desarrollo de la inmunidad adquirida en lugar de una lesión viral directa como mecanismo subyacente.
Consideraciones de manejo
La mayoría de los pacientes con MIS-C requirieron soporte vasopresor, y pocos requirieron soporte circulatorio mecánico. Debido a algunas similitudes con la enfermedad de Kawasaki, las estrategias de tratamiento han incluido inmunoglobulina intravenosa y corticosteroides, y ocasionalmente un antagonista de IL-1 (anakinra).
El tratamiento con aspirina o lovenox también se ha debatido, dado el estado hipercoagulable y la preocupación por la afectación coronaria similar a la de la enfermedad de Kawasaki. Otras terapias incluyen de remdesivir y tocilizumab.
Mujeres embarazadas
Epidemiología
No se ha demostrado que el embarazo y el parto alteren sustancialmente la susceptibilidad o el curso clínico de infección con SARS-CoV-2. Los datos preliminares indican que las tasas de admisión en la UCI para mujeres embarazadas son similares a las de la población no embarazada.
No se ha informado que las mujeres embarazadas con COVID-19 tengan complicaciones maternas graves, pero en algunos estudios se observó un mayor riesgo de parto prematuro y cesárea. La evidencia de la transmisión vertical sugiere que ésta es posible pero probablemente no es una ocurrencia común.
Fisiopatología
Se desconoce si los cambios inmunológicos normales del embarazo afectan la gravedad de la enfermedad COVID-19, una enfermedad marcada por hiperinflamación en sus formas graves. La evidencia histopatológica de infección de muestras de membrana placentaria y fetal con SARS-CoV-2 se ha informado en algunos casos, pero hasta ahora, las muestras vaginales y amnióticas han dado negativo en mujeres embarazadas infectadas con SARS-CoV-2.
Manejo
El manejo de las mujeres embarazadas hospitalizadas no es sustancialmente diferente del de las personas no embarazadas. Los cambios en la vía de parto o el manejo del trabajo de parto no se recomiendan rutinariamente para pacientes embarazadas con COVID-19.
Si bien se sabe que el SARS-CoV-2 causa una enfermedad pulmonar sustancial, incluida la neumonía y el síndrome de dificultad respiratoria aguda (SDRA), los médicos han observado muchas manifestaciones extrapulmonares de COVID-19.
Esto puede reflejar la diseminación y la replicación extrapulmonar del SARS-CoV-2, como se ha observado para otros coronavirus zoonóticos. Para proporcionar una perspectiva sobre estas manifestaciones extrapulmonares, se discute aquí la fisiopatología y el impacto clínico de COVID-19 en varios sistemas de órganos.
Fisiopatología
El SARS-CoV-2 parece emplear mecanismos para el reconocimiento de receptores similares a los utilizados por los coronavirus virulentos anteriores como el SARS-CoV, el patógeno responsable de la epidemia de SARS de 2003. La subunidad de espiga de SARS-CoV y la de SARS CoV-2 comprometen a ACE2 (enzima convertidora de angiotensina 2) como receptor de entrada. Además, la entrada celular requiere el cebado de la proteína espiga por la serina proteasa celular TMPRSS2 u otras proteasas.
Se requiere la coexpresión en la superficie celular de ACE2 y TMPRSS2 para completar este proceso de entrada. Estudios recientes han demostrado una mayor afinidad de unión de SARS-CoV-2 a ACE2 que de SARS-CoV a ACE2, lo que puede explicar parcialmente la mayor transmisibilidad de SARS-CoV-2.
| Los mecanismos clave que pueden tener un papel en la fisiopatología de la lesión multiorgánica secundaria a la infección por SARS-CoV-2 incluyen toxicidad viral directa, daño de células endoteliales y tromboinflamación, desregulación de la respuesta inmune y desregulación del sistema renina-angiotensina-aldosterona (SRAA). |
Toxicidad viral directa
El SARS-CoV-2 se transmite principalmente a través de la exposición directa o indirecta del tracto respiratorio.Tiene tropismo para el tracto respiratorio, dada la alta expresión de ACE2, su receptor de entrada, en múltiples tipos de células epiteliales de la vía aérea, incluidas las células alveolares epiteliales tipo II en el parénquima pulmonar. Más adelante en el curso de la enfermedad, la replicación viral puede ocurrir en el tracto respiratorio inferior, que se manifiesta en casos graves como neumonía y SDRA.
Estudios han aislado ARN viral de muestras fecales con títulos altos y, con menos frecuencia, de orina y sangre. Los estudios histopatológicos han informado de organotropismo del SARS-CoV-2 más allá del tracto respiratorio, incluido el tropismo a los tejidos renal, miocárdico, neurológico, faríngeo y gastrointestinal.
Estos hallazgos sugieren que la lesión de múltiples órganos puede ocurrir al menos en parte debido al daño directo viral del tejido. El mecanismo de diseminación extrapulmonar del SARS-CoV-2, ya sea hematógeno o no, sigue siendo difícil de dilucidar.
Daño de células endoteliales y tromboinflamación
El daño de las células endoteliales en virtud de la entrada mediada por ACE2 del SARS-CoV-2 y la inflamación posterior y la generación de un entorno protrombótico son otros mecanismos fisiopatológicos propuestos de COVID-19.
La expresión de ACE2 se ha demostrado en el endotelio arterial y venoso de varios órganos, y los estudios histopatológicos han encontrado evidencia microscópica de partículas virales de SARS-CoV-2 en las células endoteliales de los riñones y los pulmones.
La lesión endotelial mediada por infección (caracterizada por niveles elevados de factor von Willebrand) y endotelitis (marcada por la presencia de neutrófilos y macrófagos activados), que se encuentran en múltiples lechos vasculares (incluidos los pulmones, los riñones, el corazón, el intestino delgado y el hígado) en los pacientes con COVID-19 pueden desencadenar la producción excesiva de trombina, inhibir la fibrinólisis y activar las vías del complemento, iniciar la tromboinflamación y finalmente conducir al depósito de microtrombos y la disfunción microvascular.
La comunicación cruzada entre plaquetas y neutrófilos y la activación de macrófagos en este contexto pueden facilitar una variedad de efectos proinflamatorios, como la liberación de citocinas, la formación de trampas extracelulares de neutrófilos (NETs) y la formación de fibrina y / o microtrombos.
Las NETs dañan aún más el endotelio y activan tanto las vías de coagulación extrínsecas como las vías de coagulación intrínsecas. Finalmente, los efectos directos mediados por el coronavirus también pueden conducir a un desequilibrio de las vías pro y anticoagulantes.
Desregulación de la respuesta inmune
La respuesta inmune desregulada y el síndrome de liberación de citoquinas, debido a la hiperactivación de la inmunidad innata en el contexto de la linfodepleción de células T, caracterizan las presentaciones de COVID-19 grave.
La elevación de los marcadores inflamatorios séricos, como la proteína C reactiva, la ferritina, la velocidad de sedimentación globular, el dímero D, el fibrinógeno y la lactato deshidrogenasa es predictiva de la enfermedad crítica y mortalidad posterior en pacientes con COVID-19. Los niveles más altos de la citocina IL-6 en el suero también se han relacionado con un peor pronóstico y se ha encontrado que se correlacionan con los niveles de fibrinógeno en pacientes con COVID-19.
Desregulación del SRAA
Las funciones desadaptativas del SRAA constituyen otro mecanismo fisiopatológico plausible del daño tisular relacionado con la infección por SARS-CoV-2.La ACE2 es un potente contra-regulador de la vía SRAA. ACE2 escinde angiotensina I en angiotensina 1-9 inactiva y escinde angiotensina II en angiotensina 1-7, que tiene propiedades vasodilatadoras, antiproliferativas y antifibróticas. Si bien la fisiopatología del SARS-CoV-2 puede no limitarse exclusivamente a las vías relacionadas con ACE2, estos hallazgos pueden tener implicancias para las manifestaciones clínicas específicas de órganos de COVID-19.

• Manifestaciones hematológicas
Los pacientes con COVID-19 pueden presentar varias anomalías de laboratorio y complicaciones tromboembólicas.
Epidemiología y presentación clínica
La linfopenia, un marcador de inmunidad celular alterada, es un hallazgo cardinal de laboratorio reportado en 67 a 90% de los pacientes con COVID-19, con asociación pronóstica en la gran mayoría de los estudios publicados. Se han revelado disminuciones tanto en las células T CD4 + como en las células T CD8 + asociadas en pacientes con COVID-19 grave.
Además, la leucocitosis (especialmente la neutrofilia), que se observa con menos frecuencia, también es un marcador pronóstico negativo. La trombocitopenia, aunque a menudo es leve (en 5 a 36% de los ingresos), se asocia con peores resultados del paciente.
La coagulopatía asociada a COVID-19 está marcada por niveles elevados de dímero D y fibrinógeno, con anormalidades menores en el tiempo de protrombina, tiempo de tromboplastina parcial activada y recuentos de plaquetas en la etapa inicial de la infección. Los niveles elevados de dímero D al ingreso y un aumento longitudinal durante la hospitalización se han relacionado con una peor mortalidad en COVID-19.
Las complicaciones trombóticas se informaron en hasta el 30% de los pacientes.También hay evidencia emergente de trombosis en catéteres intravenosos y circuitos extracorpóreos, y eventos oclusivos vasculares arteriales, incluyendo infarto agudo de miocardio (IM), isquemia aguda de extremidades y accidente cerebrovascular, en personas gravemente afectadas. También se informaron altas tasas de eventos tromboembólicos en pacientes críticos con COVID-19 a pesar de haber recibido anticoagulación profiláctica.
Fisiopatología
Los posibles mecanismos propuestos por los cuales ocurre la linfopenia incluyen la acción citotóxica directa del virus relacionado con la entrada dependiente o independiente de ACE2 en los linfocitos, el agotamiento de linfocitos mediado por apoptosis y los efectos inhibitorios del ácido láctico sobre la proliferación de linfocitos. Además, se han descrito atrofia del bazo y la destrucción generalizada de los tejidos linfoides.
Se cree que la leucocitosis (especialmente la neutrofilia) es una consecuencia de una respuesta hiperinflamatoria a la infección por SARS-CoV-2 y / o infecciones bacterianas secundarias. Los niveles anormalmente altos de dímero D y fibrinógeno en la sangre durante las primeras etapas de la infección reflejan una inflamación excesiva en lugar de una coagulación intravascular diseminada manifiesta, que comúnmente se observa solo en las etapas posteriores de COVID-19.
El aumento de la expresión de ACE2 en las células endoteliales después de la infección con SARS-CoV-2 puede perpetuar un círculo vicioso de endotelitis que promueve la inflamación tromboinflamatoria. Colectivamente, los cambios hemostáticos e inflamatorios, que reflejan el daño y la activación endoteliales, así como la enfermedad crítica, constituyen un entorno protrombótico.
Consideraciones de manejo
Durante la hospitalización de pacientes con COVID-19 se recomienda la evaluación longitudinal de un recuento sanguíneo completo, con diferencial de glóbulos blancos, dímero D, tiempo de protrombina y fibrinógeno.La tendencia de estos índices inflamatorios puede ayudar a predecir los resultados clínicos y la respuesta al tratamiento. Además, las directrices recientemente publicadas recomiendan una evaluación de riesgo de rutina para el tromboembolismo venoso para todos los pacientes hospitalizados con COVID-19. La profilaxis farmacológica a dosis estándar debe considerarse en ausencia de contraindicaciones absolutas en tales pacientes.
Un análisis retrospectivo encontró tasas más bajas de mortalidad hospitalaria en pacientes con COVID-19 que recibieron anticoagulación terapéutica. Los anticoagulantes parenterales (como la heparina de bajo peso molecular o no fraccionada) se prefieren a los anticoagulantes orales en el entorno hospitalario, dada su corta vida media y la disponibilidad inmediata de agentes de reversión, debido a la posibilidad de interacciones farmacológicas cuando se están tomado con tratamientos antivirales (como ritonavir) y tratamientos antibacterianos (como azitromicina).
• Manifestaciones cardiovasculares
Se han informado varias presentaciones cardiovasculares de COVID-19.
Epidemiología y presentación clínica
El SARS-CoV-2 puede causar secuelas cardiovasculares directas y secuelas cardiovasculares indirectas, incluyendo lesiones miocárdicas, síndromes coronarios agudos (SCA), cardiomiopatía, cor pulmonale agudo, arritmias y shock cardiogénico, así como las complicaciones trombóticas mencionadas anteriormente.
La lesión miocárdica, con elevación de los biomarcadores cardíacos se produjo en el 20-30% de los pacientes hospitalizados con COVID-19, con tasas más altas (55%) entre aquellos con enfermedad cardiovascular preexistente. Una mayor frecuencia y magnitud de las elevaciones de troponina en pacientes hospitalizados se asocia con una enfermedad más grave y peores resultados. Se ha informado de miocardiopatía biventricular en 7 a 33% de los pacientes críticos con COVID-19.
También se ha informado insuficiencia ventricular derecha aislada con y sin embolia pulmonar confirmada. Las arritmias cardíacas, incluidas la fibrilación auricular de inicio reciente, el bloqueo cardíaco y las arritmias ventriculares, también son frecuentes, y ocurren en el 17% de los pacientes hospitalizados y el 44% de los pacientes.
Los informes de Lombardía, Italia, muestran un aumento de casi el 60% en la tasa de paro cardíaco extrahospitalario durante la pandemia de COVID-19 de 2020 en relación con un período de tiempo similar en 2019, lo que sugiere que la etiología sea COVID-19 u otra patología no tratada debido a la renuencia de los pacientes a buscar atención.
Fisiopatología
La fisiopatología subyacente a las manifestaciones cardiovasculares es probablemente multifactorial. ACE2 tiene una alta expresión en el tejido cardiovascular, incluidos miocitos cardíacos, fibroblastos, células endoteliales y células de músculo liso, en apoyo de un posible mecanismo de lesión viral directa.
La miocarditis es una presunta etiología de la disfunción cardíaca, y el desarrollo de la miocarditis puede estar relacionado con la carga viral. Mientras que el aislamiento del virus del tejido miocárdico se ha informado en algunos estudios de autopsia, otros informes patológicos han descrito infiltrados inflamatorios sin evidencia miocárdica de SARS-CoV-2.
El síndrome de respuesta inflamatoria sistémica (tormenta de citoquinas) es otro supuesto mecanismo de lesión miocárdica. Además, los pacientes con enfermedad cardiovascular preexistente pueden tener niveles más altos de ACE2, lo que podría predisponerlos a COVID-19 más grave.
La disfunción ventricular derecha aislada puede ocurrir como resultado de presiones vasculares pulmonares elevadas secundarias a SDRA, tromboembolismo pulmonar o lesión potencialmente mediada por virus en el tejido vascular endotelial y del músculo liso.
Otras posibles etiologías de daño miocárdico no específicas de COVID-19 incluyen isquemia severa o infarto de miocardio en pacientes con enfermedad coronaria preexistente, disfunción miocárdica mediada por estrés, miocardiopatía inducida por taquicardia y aturdimiento miocárdico después de reanimación o hipotensión prolongada.
Si bien los pacientes con infecciones virales corren el riesgo de infarto de miocardio en general, este riesgo puede ser exagerado en pacientes con COVID-19, dados los informes de hipercoagulabilidad desproporcionadamente aumentada en las personas afectadas, lo que llevaría a un posible aumento en el IM mediado trombóticamente.
Consideraciones de manejo
Si la regulación positiva de ACE2 por los inhibidores de la ECA (IECA) o los bloqueadores de los receptores de angiotensina (ARA) protege los pulmones o aumenta la susceptibilidad a la infección por SARS-CoV-2, se ha debatido intensamente.
Esto tiene implicancias para los pacientes con hipertensión, insuficiencia cardíaca y / o diabetes, que están sobrerrepresentados entre los pacientes críticos con COVID-19. No hay evidencia que respalde una asociación entre el uso de IECA y ARA y enfermedad más grave.
No se recomienda la interrupción rutinaria de estos medicamentos, como lo avalan las pautas de varias sociedades internacionales de cardiología.En cuanto al manejo del SCA, aunque la intervención coronaria percutánea primaria sigue siendo el enfoque preferido para la mayoría de los pacientes con infarto de miocardio con elevación del segmento ST, la terapia fibrinolítica puede ser apropiada en pacientes seleccionados, especialmente si el equipo de protección personal no está disponible.
Además, la ecocardiografía en el punto de atención se puede usar para evaluar las anomalías para guiar las decisiones sobre el cateterismo cardíaco. Los procedimientos menos urgentes o electivos se deben diferir para minimizar el riesgo de transmisión viral. El intervalo QTc basal del paciente debe obtenerse antes de la administración de cualquier medicamento que pueda conducir a la prolongación de este intervalo.
• Manifestaciones renales
Una proporción sustancial de pacientes con COVID-19 grave puede mostrar signos de daño renal.
Epidemiología y presentación clínica
La lesión renal aguda (IRA) es una complicación frecuente de COVID-19 y está asociada con la mortalidad. En un estudio de casi 5.500 pacientes de Nueva York, la IRA ocurrió en el 37%, y el 14% de los pacientes requirió diálisis. La IRA se produjo a tasas mucho más altas en pacientes críticos, entre un 78% y 90%. Además, se ha informado hematuria en casi la mitad de los pacientes con COVID-19, y se ha informado de proteinuria en hasta el 87% de los pacientes críticos con COVID-19.
La hipercalemia y la acidosis son anormalidades electrolíticas comunes asociadas con la alta renovación celular observada en pacientes con COVID-19, incluso entre pacientes sin IRA. COVID-19 también se informa cada vez más entre pacientes con enfermedad renal en etapa terminal y receptores de trasplante de riñón, con tasas de mortalidad más altas que las observadas en la población general.
Fisiopatología
Cabe destacar varios posibles mecanismos.
- Primero, el SARS-CoV-2 puede infectar directamente las células renales, una posibilidad respaldada por los hallazgos histopatológicos y la presencia de receptores ACE2. Las partículas de inclusión viral con picos distintivos en el epitelio tubular y los podocitos, y las células endoteliales de las asas capilares glomerulares, se han visualizado por microscopía electrónica.
- En segundo lugar, la demostración de la endotelitis linfocítica en el riñón, además de las partículas de inclusión viral en las células endoteliales capilares glomerulares, sugiere que la disfunción microvascular es secundaria al daño endotelial.
- Tercero, la tormenta de citoquinas puede tener un papel importante en la inmunopatología de la IRA. La lesión glomerular mediada por inmunocomplejos de antígenos virales o mecanismos efectores inmunológicos específicos inducidos por virus también es plausible.
- Cuarto, finalmente, aunque la proteinuria no es una manifestación típica de IRA, la macroalbuminuria transitoria puede ocurrir secundaria a disfunción endotelial o lesión directa de podocitos. Otras posibles etiologías de IRA comunes a presentaciones de enfermedades críticas, como SDRA, rabdomiólisis, disminución de volumen y nefritis intersticial, siguen siendo relevantes en pacientes con COVID-19.
El análisis de orina y el cociente proteinuria-creatininuria se pueden obtener al ingreso para pacientes con COVID-19, ya que la proteinuria y la hematuria parecen estar asociadas con un curso clínico más severo y una mortalidad más alta, y esto brindaría una oportunidad para la estratificación temprana del riesgo.
Se debe poner énfasis en la optimización de la volemia para prevenir la IRA prerrenal, particularmente dada la alta prevalencia de IRA, evitando la hipervolemia que puede empeorar el estado respiratorio del paciente.
Las pautas recomiendan una estrategia conservadora de reanimación con líquidos al tiempo que reconocen que la base de evidencia de apoyo es débil. Un aumento dramático en la necesidad de TRR en pacientes críticos puede requerir una planificación juiciosa de los recursos.
El estado protrombótico plantea desafíos adicionales en el inicio y mantenimiento de los circuitos extracorpóreos necesarios para la TRR. En ausencia de contraindicaciones, los pacientes con COVID-19 pueden requerir anticoagulación sistémica durante la TRR.
• Manifestaciones gastrointestinales
COVID-19 puede causar síntomas gastrointestinales en algunos pacientes.
Epidemiología y presentación clínica
La incidencia de manifestaciones gastrointestinales ha oscilado entre 12% y 61%. Los síntomas gastrointestinales pueden estar asociados con una mayor duración de la enfermedad, pero no se han asociado con una mayor mortalidad.
En un metaanálisis reciente se informó la prevalencia combinada de síntomas individuales, incluida la anorexia (21%), náuseas y / o vómitos (7%), diarrea (9 %) y dolor abdominal (3%). En un estudio de los EE. UU., se informó una mayor prevalencia de estos síntomas.
Fisiopatología
La fisiopatología del daño gastrointestinal en COVID-19 es probablemente multifactorial. El daño tisular directo mediado por virus es plausible, dada la presencia de ACE2 en las células glandulares intestinales, así como la visualización de la proteína nucleocápside viral en las células epiteliales gástricas, duodenales y rectales, y los enterocitos glandulares.
El ARN viral se ha aislado de las heces, con una tasa de positividad del 54%. Se ha informado de la eliminación viral de viriones infecciosos en materia fecal incluso después de la resolución de los síntomas. Además, la evidencia histopatológica sugiere una lesión microvascular del intestino delgado.
La presencia de células plasmáticas y linfocitos infiltrantes y de edema intersticial en la lámina propia del estómago, el duodeno y el recto de los pacientes apoya el daño tisular mediado por la inflamación. También se ha planteado la hipótesis de que la alteración de la flora intestinal por el virus puede contribuir a los síntomas gastrointestinales y la progresión grave de la enfermedad.
Consideraciones de manejo
Las pautas actuales de múltiples sociedades enfatizan evitar de la endoscopia diagnóstica por razones no urgentes durante la pandemia de COVID-19. Se ha informado que los pacientes que presentan síntomas gastrointestinales y luego dan positivo por SARS-CoV-2 presentan retrasos en el diagnóstico.
Cuando sea factible, COVID-19 debe considerarse como un diagnóstico diferencial en estos pacientes, incluso en ausencia de síntomas respiratorios. En entornos con recursos limitados, los pacientes con síntomas de diarrea o náuseas y / o vómitos además de síntomas respiratorios deben tener prioridad para el testeo.
• Manifestaciones hepatobiliares
Se pueden observar signos de daño hepatobiliar en pacientes con presentaciones graves de COVID-19.
Epidemiología y presentación clínica
En pacientes críticos con COVID-19, se observa un patrón de lesión hepatocelular en 14-53% de los pacientes hospitalizados. Las aminotransferasas son típicamente elevadas, pero permanecen menos de cinco veces el límite superior de lo normal.
Una revisión sistemática reciente informó una prevalencia combinada de anormalidades de la función hepática del 19% con una asociación con la gravedad de la enfermedad. La bilirrubina elevada al ingreso hospitalario también se ha relacionado con la gravedad de la enfermedad y la progresión a enfermedad crítica en algunos estudios.
Fisiopatología
El SARS-CoV-2 puede dañar directamente los conductos biliares al unirse a ACE2 en los colangiocitos. La hiperinflamación observada con la tormenta de citoquinas y los trastornos metabólicos asociados con la hipoxia son otros mecanismos potenciales de daño hepático. También puede producirse una lesión hepática inducida por fármacos, particularmente secundaria a agentes en investigación como remdesivir, lopinavir y tocilizumab.
Otros cambios histopatológicos en el hígado incluyeron esteatosis hepática, fibrosis portal, infiltrados linfocíticos y proliferación ductular, colestasis lobular y necrosis aguda de células hepáticas, junto con trombosis de vena central.
Consideraciones de manejo
No se recomiendan pruebas de diagnóstico adicionales para elevaciones de aminotransferasas a menos que características adicionales aumenten la probabilidad de hallazgos que requieran medidas adicionales (como hiperbilirrubinemia, dolor de cuadrante superior derecho y hepatomegalia).
Se deben considerar otras etiologías relacionadas con COVID-19 de bioquímicas hepáticas elevadas, como miositis, lesión cardíaca (junto con elevación de troponina), isquemia, síndrome de liberación de citocinas y coinfección con otros virus. Se recomienda la monitorización longitudinal de las transaminasas hepáticas, particularmente en pacientes que reciben tratamientos en investigación.
• Manifestaciones endocrinológicas
Mientras que los pacientes con trastornos endocrinológicos preexistentes pueden estar predispuestos a presentaciones más graves de COVID-19, también se han realizado observaciones de una variedad de manifestaciones endocrinológicas en pacientes sin enfermedad preexistente.
Epidemiología y manifestaciones clínicas
Los pacientes con diabetes mellitus y / u obesidad corren el riesgo de desarrollar una enfermedad COVID-19 más grave. En un informe de los CDCs de EE. UU., el 24% de los pacientes hospitalizados y el 32% de los pacientes ingresados en la UCI tenían diabetes subyacente.
Estudios de China e Italia demostraron una asociación de diabetes subyacente con enfermedad grave y muerte. Además, los pacientes hospitalizados con COVID-19 han exhibido una variedad de anormalidades en el metabolismo de la glucosa, incluyendo hiperglucemia empeorada, cetosis euglucémica y cetoacidosis diabética clásica.
En un estudio retrospectivo de China, entre un grupo de 658 pacientes hospitalizados con COVID-19, el 6,4% presentó cetosis en ausencia de fiebre o diarrea. De estos, el 64% no tenía diabetes subyacente (con un nivel promedio de hemoglobina A1c del 5,6% en este grupo).
Fisiopatología
Los factores relacionados con el SARS-CoV-2 incluyen niveles de citocinas sustancialmente elevados, lo que puede conducir a alteraciones en la función de las células β pancreáticas y su apoptosis y, en consecuencia, a una disminución de la producción de insulina y cetosis. La expresión de ACE2 se ha informado en el páncreas endocrino, aunque de manera inconsistente.
Esto plantea la posibilidad de que la unión directa de SARS-CoV-2 a ACE2 en las células β pueda contribuir a la deficiencia de insulina y la hiperglucemia, como se ha demostrado previamente para la infección con SARS-CoV. Otros factores no específicos incluyen una respuesta inmune alterada y un aumento en las hormonas contrarreguladoras que promueven la producción de glucosa hepática, disminución de la secreción de insulina, cetogénesis y resistencia a la insulina.
Las manifestaciones extrapulmonares clave de COVID-19 también pueden estar relacionadas con complicaciones diabéticas, desde la función renal reducida hasta los estados pro-trombóticos y coagulopáticos, hasta la disfunción cardíaca y la lesión de los hepatocitos.
La obesidad es otro factor de riesgo para la enfermedad más grave en COVID-19.Esto puede estar relacionado con sus efectos sobre la función pulmonar, como la reducción de los volúmenes pulmonares y la compliance, y un aumento de la resistencia de las vías respiratorias, así como una asociación con la diabetes. Además, el aumento de la adiposidad se ha relacionado con alteraciones en múltiples citocinas, quimiocinas y adipocinas, que pueden exacerbar la respuesta inflamatoria vista en esta enfermedad.
Consideraciones de manejo
La HbA1C debe evaluarse en pacientes con COVID-19 que presenten hiperglucemia y / o cetoacidosis, para identificar diabetes posiblemente no diagnosticada. El manejo de la cetoacidosis diabética plantea un mayor riesgo para el personal médico, debido a la necesidad de controles de glucosa por hora mientras los pacientes reciben goteo de insulina.
Puede haber una función para el monitoreo remoto de glucosa a través de monitores continuos de glucosa para aliviar este problema y reducir las demandas del personal de enfermería. Los protocolos alternativos para insulina subcutánea en grupos seleccionados de pacientes con cetoacidosis diabética de leve a moderada se pueden considerar individualmente.
• Manifestaciones neurológicas y oftalmológicas
Hay evidencia creciente de complicaciones neurológicas de COVID-19
Epidemiología y presentación clínica
Se han descrito múltiples manifestaciones neurológicas de COVID-19. Un análisis de 214 pacientes con COVID-19 grave encontró que los síntomas neurológicos ocurrieron en el 36% de los pacientes.
Una serie de síntomas neurológicos leves inespecíficos son notables en pacientes hospitalizados con COVID-19, incluyendo dolor de cabeza (8–42%), mareos (12%), mialgia y / o fatiga (11–44%), anorexia (40%), anosmia (5%) y ageusia (5%), aunque la epidemiología puede ser diferente en presentaciones ambulatorias más leves.
Las presentaciones más graves de COVID-19 se manifiestan con accidente cerebrovascular agudo (hasta en el 6% de las personas con enfermedad grave) y confusión o alteración de la conciencia (8–9%). El síndrome de Guillain-Barré también se ha informado en algunos pacientes.
Además, se han descrito meningoencefalitis, síndrome de encefalopatía posterior reversible hemorrágica y encefalopatía necrotizante aguda. También se han notificado manifestaciones oculares, como congestión conjuntival sola, conjuntivitis y cambios en la retina.
Fisiopatología
Otros coronavirus tienen capacidades neuroinvasivas y neurotrópicas conocidas. La invasión viral directa del parénquima neural es una posibilidad; el SARS-CoV-2 puede acceder al sistema nervioso central a través de la mucosa nasal, la lámina cribosa y el bulbo olfatorio o por transporte axonal retrógrado.
Las células epiteliales nasales muestran la expresión más alta de ACE2 en el árbol respiratorio; esto puede explicar los síntomas de alteración del sentido del gusto o del olfato, frecuentemente reportados retrospectivamente en la mayoría de los pacientes.
Otras manifestaciones neurológicas apoyan, al menos, la neurovirulencia de COVID-19, tal vez reflejando la cascada proinflamatoria y protrombótica a raíz de la tormenta de citocinas, ya que afecta la vasculatura cerebral y la barrera hematoencefálica.
Consideraciones de manejo
Las pautas exigen el cumplimiento continuo de las recomendaciones establecidas para el accidente cerebrovascular isquémico agudo, incluido el acceso a la trombolisis y la trombectomía, al tiempo que se reconoce la necesidad de minimizar el uso de equipos de protección personal. Las pautas de monitoreo de la atención post-aguda pueden ajustarse para las restricciones pandémicas.
También se recomienda el uso del 'telestroke' o evaluación remota de pacientes que han sufrido un derrame cerebral. Se están investigando consideraciones a largo plazo, como el compromiso neurodegenerativo y neuroinflamatorio posinfeccioso, así como la eficacia de una vacuna eventual en algunas poblaciones inmunodeprimidas.
• Manifestaciones dermatológicas
En ocasiones, se han descrito manifestaciones dermatológicas en pacientes que padecen COVID-19.
Epidemiología y presentación clínica
En un estudio observacional en Italia, aproximadamente el 44% de los pacientes tenían hallazgos cutáneos al inicio de la enfermedad, mientras que los pacientes restantes los desarrollaron durante el curso de su enfermedad.
No se observó correlación con la gravedad de la enfermedad en este pequeño estudio. Las manifestaciones cutáneas incluyeron erupción eritematosa, urticaria y vesículas similares a la varicela. Una revisión sistemática de 46 estudios encontró que las lesiones acrocutáneas (pernio o tipo sabañones) son la manifestación cutánea más comúnmente informada, asociadas con COVID-19 menos grave.
Otros hallazgos cutáneos incluyeron lesiones livedoides y / o necróticas, observadas en COVID-19 más grave. Los informes de casos también han descrito erupciones exantematosas y petequias.
Fisiopatología
La exposición a fármacos y la asociación temporal con hidroxicloroquina, remdesivir, tocilizumab y otros fármacos experimentales siempre deben evaluarse antes de que cualquier lesión cutánea se atribuya a la infección viral.
Los mecanismos potenciales para las manifestaciones cutáneas relacionadas con COVID-19 incluyen una respuesta de hipersensibilidad inmune al ARN del SARS-CoV-2, el síndrome de liberación de citocinas, el depósito de microtrombos y la vasculitis. En ocasiones se han visto pequeños trombos en los vasos de la dermis.
Consideraciones de manejo
La mayoría de las manifestaciones cutáneas de COVID-19 se han resuelto por sí mismas. No se entiende claramente si los pacientes con enfermedades dermatológicas que reciben terapias biológicas tienen un mayor riesgo de complicaciones por COVID-19.
La Academia Estadounidense de Dermatología recomienda la interrupción de la terapia biológica en pacientes con COVID-19 positivo (similar a la recomendación para pacientes con otras infecciones activas) y recomienda una discusión caso por caso sobre la continuación de estos medicamentos para pacientes de riesgo.
Consideraciones especiales en COVID-19
Aquí revisamos las características epidemiológicas y clínicas de pacientes pediátricas y embarazadas con COVID-19.
Niños
Epidemiología y presentación clínica
En una revisión de 72.314 pacientes con COVID-19 informados por el CDC Chino, menos del 1% de los pacientes eran menores de 10 años de edad. En dos estudios retrospectivos, la mayoría de los pacientes tenían enfermedad leve o moderada, y solo el 1.8% requirió ingreso en la UCI, con dos muertes reportadas. En un estudio reciente de un gran grupo de UCI pediátricas de América del Norte, el 38% de los 48 niños críticos necesitaron ventilación invasiva, con una tasa de mortalidad hospitalaria del 4,2%.
En la fase posterior de la pandemia, médicos de Europa y Estados Unidos destacaron informes de niños sanos que presentaban un shock inflamatorio severo que tenía características similares a las de la enfermedad de Kawasaki atípica o el síndrome de shock tóxico.
Este síndrome se reconoció como síndrome inflamatorio multisistémico en niños (MIS-C) y se definió de la siguiente manera: una persona <21 años de edad que presenta fiebre, evidencia de laboratorio de inflamación y evidencia de enfermedad clínicamente grave que requiere hospitalización, con dos o más sistemas de órganos afectados en el contexto de infección actual o reciente con SARS-CoV-2. Si no se trata, la enfermedad de Kawasaki puede provocar aneurismas coronarios en el 25% de los pacientes.
Fisiopatología
Las posibles razones de las manifestaciones menos graves de COVID-19 en niños incluyen la evolución de la expresión de ACE2 y la inmunidad de las células T y un entorno de citocinas proinflamatorio con la edad. También se ha planteado la hipótesis de la posibilidad de competencia entre el SARS-CoV-2 y otros virus preexistentes que son comunes en la mucosa respiratoria de niños pequeños.
Por el contrario, el aumento de la expresión de ACE2 alrededor del nacimiento, antes de su disminución, y una capacidad reducida de las células T para combatir las infecciones virales al nacer pueden ser responsables de la susceptibilidad de los bebés al COVID-19 grave.
Curiosamente, muchos niños con MIS-C dieron negativo para SARS-CoV-2 pero positivo para anticuerpos, lo que sugiere un posible desencadenante del desarrollo de la inmunidad adquirida en lugar de una lesión viral directa como mecanismo subyacente.
Consideraciones de manejo
La mayoría de los pacientes con MIS-C requirieron soporte vasopresor, y pocos requirieron soporte circulatorio mecánico. Debido a algunas similitudes con la enfermedad de Kawasaki, las estrategias de tratamiento han incluido inmunoglobulina intravenosa y corticosteroides, y ocasionalmente un antagonista de IL-1 (anakinra).
El tratamiento con aspirina o lovenox también se ha debatido, dado el estado hipercoagulable y la preocupación por la afectación coronaria similar a la de la enfermedad de Kawasaki. Otras terapias incluyen de remdesivir y tocilizumab.
Mujeres embarazadas
Epidemiología
No se ha demostrado que el embarazo y el parto alteren sustancialmente la susceptibilidad o el curso clínico de infección con SARS-CoV-2. Los datos preliminares indican que las tasas de admisión en la UCI para mujeres embarazadas son similares a las de la población no embarazada.
No se ha informado que las mujeres embarazadas con COVID-19 tengan complicaciones maternas graves, pero en algunos estudios se observó un mayor riesgo de parto prematuro y cesárea. La evidencia de la transmisión vertical sugiere que ésta es posible pero probablemente no es una ocurrencia común.
Fisiopatología
Se desconoce si los cambios inmunológicos normales del embarazo afectan la gravedad de la enfermedad COVID-19, una enfermedad marcada por hiperinflamación en sus formas graves. La evidencia histopatológica de infección de muestras de membrana placentaria y fetal con SARS-CoV-2 se ha informado en algunos casos, pero hasta ahora, las muestras vaginales y amnióticas han dado negativo en mujeres embarazadas infectadas con SARS-CoV-2.
Manejo
El manejo de las mujeres embarazadas hospitalizadas no es sustancialmente diferente del de las personas no embarazadas. Los cambios en la vía de parto o el manejo del trabajo de parto no se recomiendan rutinariamente para pacientes embarazadas con COVID-19.
| Conclusiones y direcciones futuras • Más allá de las complicaciones pulmonares potencialmente mortales del SARS-CoV-2, se aprecian cada vez más otras manifestaciones específicas de órganos por COVID-19. Es imperativo desarrollar una comprensión integral de las fisiopatologías comunes y específicas de los órganos y las manifestaciones clínicas de esta enfermedad multisistémica. • También es importante que los científicos identifiquen y persigan prioridades de investigación claras que ayuden a dilucidar varios aspectos de lo que sigue siendo una enfermedad poco conocida. Algunos ejemplos de áreas que requieren mayor atención incluyen la aclaración del mecanismo por el cual el SARS-CoV-2 se disemina a los tejidos extrapulmonares, la comprensión de las propiedades virales que pueden mejorar la propagación extrapulmonar, la contribución de la inmunopatología y el efecto de las terapias antiinflamatorias, la anticipación de los efectos a largo plazo de la lesión multiorgánica, la identificación de factores que explican la variabilidad en la presentación y la gravedad de la enfermedad, y los mecanismos biológicos y sociales que subyacen a las disparidades en los resultados. • También se necesitan definiciones comunes y estándares de datos para la investigación relacionada con COVID-19. Las colaboraciones regionales, nacionales e internacionales de médicos y científicos centrados en prácticas de investigación de alta calidad, transparentes, éticas y basadas en evidencia ayudarían a impulsar a la comunidad global a lograr el éxito contra esta pandemia. |
































No hay comentarios:
Publicar un comentario