
Actualización sobre manejo y controversias | 29 SEP 20
Tromboembolismo pulmonar
El tromboembolismo venoso es el tercer trastorno cardiovascular más común y afecta hasta al 5% de la población durante su vida
Autor/a: L. Duffett, L. Castellucci y M. Forgie Fuente: BMJ 2020;370:m2177 Pulmonary embolism: update on management and controversies
Introducción
El tromboembolismo venoso, que incluye trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP), es el tercer trastorno cardiovascular más común y afecta hasta al 5% de la población durante su vida. La mayor sensibilidad de las modalidades de diagnóstico por imágenes ha más que duplicado las tasas de ingreso hospitalario por embolia pulmonar en los últimos 10 años, aunque la tasa de letalidad se ha mantenido estable o disminuido.
Se cree que la embolización de una TVP en la extremidad inferior hacia las arterias pulmonares es el mecanismo más común de embolia pulmonar. Los estudios de registro encontraron que hasta el 17% de los pacientes mueren dentro de los tres meses posteriores al diagnóstico de tromboembolismo venoso, aunque muchas de estas muertes pueden deberse a comorbilidades asociadas más que a una causalidad directa.
Varios scores de predicción de riesgo, biomarcadores séricos y anomalías en las imágenes, como la distensión ventricular derecha, pueden identificar a los pacientes con mayor riesgo a corto plazo de mortalidad por todas las causas. Esta revisión está dirigida a los médicos que atienden a pacientes con embolia pulmonar y a los investigadores interesados en los avances recientes en su tratamiento.
Epidemiología
La incidencia anual del TEP en la población es de 1 por 1.000 personas, pero aumenta drásticamente con la edad, de 1,4 por 1.000 personas de 40 a 49 años a 11,3 por 1000 de 80 años o más. El tromboembolismo venoso (TEV) recurrente ocurre en el 30% de las personas, lo que hace que la tasa de ataque (incluido el TEV incidente y recurrente) sea más alta, estimada en hasta 30 por 1000 personas-año.
La influencia de la raza en la incidencia de TEV es incierta, pero la incidencia puede ser mayor en poblaciones blancas y afroamericanas y menor en asiáticos y nativos americanos. En general, la incidencia en hombres es ligeramente mayor que en mujeres, pero el equilibrio cambia según las categorías de edad. Entre las mujeres menores de 45 años o mayores de 80 años, la incidencia de TEV es mayor que en los hombres.
El 50% de los episodios de TEV están asociados con un factor de riesgo transitorio, como una cirugía reciente o el ingreso hospitalario por una enfermedad médica y el 20% están asociados con el cáncer.
A pesar de la literatura exhaustiva sobre epidemiología y factores de riesgo, la conciencia pública es escasa en comparación con otras afecciones de salud con una incidencia comparable. Esto quedó ilustrado en una encuesta internacional a más de 7.000, donde la mitad de los encuestados no tenía conocimiento de las condiciones y factores de riesgo del tromboembolismo venoso, y menos del 30% conocía sus signos y síntomas.
Fuentes y criterios de selección
Se realizaron búsquedas en Ovid Medline, Cochrane CENTRAL y otras citas no indexadas desde el 1 de enero de 2010 hasta el 7 de agosto de 2019 para encontrar revisiones sistemáticas, metanálisis y ensayos controlados aleatorizados en inglés que evaluaran el tratamiento de la embolia pulmonar; incluimos guías de práctica clínica.
Se usaron Ovid Medline y PubMed para estrategias de búsqueda dedicadas de temas seleccionados que se creía que no estaban incluidos en la búsqueda anterior. Estos temas incluyeron filtros de la vena cava inferior, sangrado y anticoagulación, síndrome postrombótico, síndrome postrombótico, hipertensión pulmonar tromboembólica crónica, calidad de vida y experiencia del paciente, cáncer, trombofilia hereditaria y síndrome antifosfolípido.
Al final, se incluyeron 11 guías de práctica clínica/declaraciones de consenso aprobadas, 24 revisiones sistemáticas / metanálisis, 25 ensayos aleatorizados, 39 estudios prospectivos y 21 estudios de análisis retrospectivos / secundarios informaron nuestra descripción general.
También se incluyeron seis ensayos clínicos de reclutamiento activo; después de que se aceptara esta revisión para su publicación, se completó uno de estos ensayos clínicos (CARAVAGGIO), y se publicaron sus resultados; los autores actualizaron entonces el manuscrito para incluir los detalles de este ensayo y sus resultados.
Diagnóstico
Es necesario el reconocimiento rápido de una constelación de signos y síntomas inespecíficos para el diagnóstico de TEP. Es prudente iniciar de inmediato la anticoagulación mientras se esperan resultados de las pruebas debido al alto riesgo de mortalidad temprana con embolia pulmonar no tratada.
Aunque este enfoque para iniciar la anticoagulación en pacientes en los que se sospecha una embolia pulmonar ha demostrado ser seguro en entornos ambulatorios, persisten los riesgos de hemorragia y uso excesivo de pruebas de diagnóstico. Proceder de manera inapropiada también puede distraer a los médicos de identificar las causas alternativas de los síntomas.
• Escalas de predicción clínica
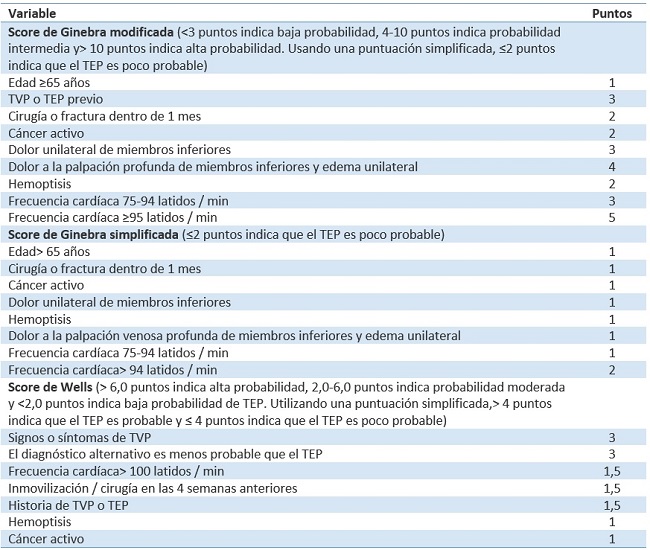
Las escalas de predicción clínica se pueden utilizar para asignar una probabilidad pre-test de embolia pulmonar. La consideración de la probabilidad pre-test evita pruebas innecesarias y es fundamental para la interpretación de los resultados. Las de Ginebra y Wells se encuentran entre las escalas de predicción clínica más comúnmente citadas.
Tanto el puntaje de Ginebra como el de Wells se han estudiado en más de 55.000 pacientes y se ha demostrado que son fiables, precisas y superiores a una evaluación clínica no estandarizada. Existe una adaptación del score de Wells, que mantiene solo tres elementos (signos clínicos de TVP, hemoptisis y si la embolia pulmonar es el diagnóstico más probable), la escala YEARS.
A pesar del uso rutinario de escalas de probabilidad clínica, solo el 8% de los pacientes en los EE.UU. y el 27% en Europa investigados por TEP tendrán el diagnóstico confirmado. Para superar esto, los criterios de descarte de embolia pulmonar (regla PERC) se estudiaron en un ensayo de 1.916 pacientes.
La regla PERC consta de ocho puntos o variables clínicas (hipoxia, edema unilateral del miembro inferior, hemoptisis, TEV previo, cirugía o traumatismo reciente, edad> 50 años, uso de hormonas, taquicardia) y no se realizaron pruebas adicionales (dímero D y / o imágenes) si las ocho variables estuvieran ausentes.
Este estudio mostró que en los pacientes considerados con muy bajo riesgo de embolia pulmonar por gestalt, la regla PERC no fue inferior a la atención estándar para el resultado primario de la tasa de TEV durante tres meses de seguimiento (diferencia media 0,2, límite de confianza superior del 95% unilateral 1,6%). La regla PERC no debe aplicarse a pacientes con mayor riesgo de embolia pulmonar, definida como una probabilidad pre-test de embolia pulmonar superior al 15%.
Fisiológicamente, la activación de la coagulación y la generación de fibrina reticulada conducen simultáneamente a la activación de la fibrinólisis. El dímero D es un producto de degradación de la fibrinólisis y aumenta en pacientes con TEV agudo y otros trastornos no trombóticos.
El dímero D es una herramienta de diagnóstico útil, y un valor negativo en combinación con una probabilidad clínica baja es útil para excluir un diagnóstico de tromboembolismo venoso.
El dímero D no debe utilizarse como herramienta de detección en pacientes en los que no se sospecha clínicamente de TEV. Los médicos deben evaluar la probabilidad clínica pre-test de embolia pulmonar antes de solicitar la prueba del dímero D, ya que el conocimiento de los resultados del dímero D puede influir en la evaluación de la probabilidad clínica.
Alternativamente, las concentraciones de dímero D aumentan con la edad y la especificidad se puede mejorar con un valor de corte ajustado por edad, como por ejemplo los utilizados por un estudio observacional (valor de corte de 500 µg/l para pacientes ≤50 o edad × 10 µg/l para pacientes >50 años). En ese estudio, la tasa de TEV a los tres meses en pacientes con una concentración de dímero D superior a 500 μg/l pero por debajo del valor de corte ajustado por edad fue de 1 en 331 pacientes (0,3%, 0,1% a 1,7%).
• Imágenes por sospecha de TEP
Históricamente, la prueba diagnóstica de referencia para la embolia pulmonar ha sido la angiografía pulmonar; este procedimiento invasivo se ha abandonado en gran medida. Las gammagrafías pulmonares de ventilación-perfusión y la angiografía pulmonar por tomografía computarizada (CTPA) son pruebas de imagen validadas.
Ambos deben usarse en combinación con los scores de probabilidad y la prueba del dímero D para interpretar con precisión los resultados, ya que se pueden observar resultados falsos negativos y falsos positivos cuando los resultados de la prueba no coinciden con las puntuaciones de probabilidad clínica (figura 2).
Un CTPA normal se asocia con una incidencia combinada de TEV a los tres meses del 1,2% (0,8% al 1,8%) y un valor predictivo negativo del 98,8% (98,2% a 99,2%). Una gammagrafía pulmonar de ventilación-perfusión en un algoritmo de diagnóstico validado funciona igual de bien que la CTPA.
Los pacientes con embolia pulmonar excluidos por un algoritmo de diagnóstico que combina exploración pulmonar de ventilación-perfusión, dímero D, ecografía por compresión y score de probabilidad clínica tuvieron una incidencia de TEV a los tres meses del 0,1% (0,0% a 0,7%) con un valor predictivo negativo de 99,5% (99,1% a 100%).
Un ECA que comparó la CTPA y la gammagrafía pulmonar de ventilación-perfusión encontró que la CTPA detectó un 5% (1,1% a 8,9%) más de embolias pulmonares, pero los pacientes en los que se excluyó la embolia pulmonar mediante un algoritmo de diagnóstico basado en la gammagrafía pulmonar de ventilación-perfusión no tenían una mayor incidencia de TEV a tres meses durante el seguimiento. No obstante, la amplia disponibilidad, la menor cantidad de resultados no diagnósticos y la capacidad de proporcionar diagnósticos alternativos han convertido a la CTPA en la modalidad de diagnóstico más común.
Sin embargo, las importantes limitaciones, como la exposición a la radiación ionizante y el riesgo de malignidad secundaria, toxicidad renal en pacientes con enfermedad renal preexistente, y el riesgo de sobre-diagnóstico y tratamiento excesivo de embolia pulmonar clínicamente insignificante, puede hacer que los médicos reevalúen la elección de este método. Sobre la exploración con tomografía computarizada por emisión de fotón único (SPECT), los autores sugieren favorecer la prueba de ventilación-perfusión ya que la técnica y los criterios de diagnóstico del SPECT son variables y no se han validado lo suficiente.
• Diagnóstico de TEP en el embarazo
El embarazo y el período posparto confieren un mayor riesgo de TEV, pero solo al 4-7% de las mujeres investigadas se les diagnostica un TEP asociado al embarazo. El diagnóstico es un desafío, ya que la dificultad para respirar y la hinchazón de las extremidades inferiores son quejas comunes y la concentración de dímero D aumenta en embarazos normales.
Un estudio observacional de 510 mujeres embarazadas aplicó la escala YEARS y el dímero D con un punto de corte estratificado (1000 ng/ml si no se cumplieron los criterios o 500 ng/ml si se cumplieron uno o más criterios). La ecografía de compresión se realizó solo en mujeres con síntomas de TVP. Con este enfoque, el 39% de las mujeres pudieron evitar las imágenes de diagnóstico, con una incidencia de TEV de tres meses aceptablemente baja de 0,21% (0,04% a 1,2%). El algoritmo YEARS adaptado al embarazo parece ser seguro y eficaz para reducir la necesidad de diagnóstico por imágenes en algunas pacientes.
Las opciones de diagnóstico por imagen para la sospecha de TEP durante el embarazo son similares a las de las pacientes no embarazadas. Tanto las gammagrafías pulmonares de ventilación-perfusión como la CTPA son modalidades de diagnóstico por imágenes seguras y precisas durante el embarazo. La exposición fetal a la radiación está muy por debajo de los límites aceptables para ambas pruebas. Dada la edad más joven, y por lo tanto el riesgo de por vida más largo de neoplasias malignas secundarias, los autores sugieren el uso de gammagrafías pulmonares de ventilación-perfusión en mujeres embarazadas.
La ecografía de compresión como primera prueba se puede considerar en pacientes que tengan síntomas que sugieran TVP. La ausencia de TVP no excluye la necesidad de imágenes de tórax, pero si se confirma una TVP proximal, se puede hacer un diagnóstico presuntivo de embolia pulmonar sin imágenes específicas.
• Prueba de trombofilia
Los antecedentes familiares de TEV presagian un mayor riesgo, particularmente cuando el TEV no es provocado o el paciente es menor de 50 años. A pesar de esto, persiste una controversia considerable en torno al valor de las pruebas de trombofilia hereditaria, ya que la evidencia sugiere que la presencia de trombofilia no altera el manejo.
Además, las pruebas de trombofilia no identifican todas las causas hereditarias de tromboembolismo venoso. Esto se ilustra con la observación de que solo el 30% de las personas con antecedentes familiares de un pariente de primer grado con TEV tendrán una prueba de detección de trombofilia positiva.
Los pacientes que tienen un TEV diagnosticado en el contexto de un factor de riesgo provocador fuerte, como una cirugía mayor, tienen un riesgo bajo de recurrencia, y este riesgo no se ve alterado significativamente por la presencia de una trombofilia hereditaria. Los pacientes que tienen un TEV que se clasifica como no provocado tienen un riesgo significativamente mayor de recurrencia, pero las pruebas de trombofilia hereditaria no han demostrado alterar este riesgo de una manera que pueda guiar las decisiones sobre la duración de la anticoagulación.
Los familiares identificados como portadores asintomáticos de trombofilia tienen un mayor riesgo de por vida de TEV, pero la mitad de todos los eventos ocurren con factores de riesgo adicionales que los provocan. La presencia de antecedentes familiares positivos sigue siendo significativa, ya que estos pacientes tienen más probabilidades de desarrollar un evento de TEV en comparación con aquellos con una trombofilia hereditaria sin antecedentes familiares.
Por lo tanto, no está claro cómo las pruebas de trombofilia informan el cuidado de los miembros de la familia sin síntomas más allá de la consideración del riesgo impuesto por un historial familiar positivo.
Si se utiliza la prueba de trombofilia, debe realizarse después de completar el tratamiento para un evento de TEV agudo y preferiblemente en ausencia de terapia anticoagulante, ya que los resultados falsos positivos están asociados con warfarina (deficiencia de proteína C, deficiencia de proteína S), heparina (anticoagulante lúpico) y ACOD (anticoagulante lúpico). Los autores sugieren no realizar pruebas de trombofilia hereditaria cuando el TEV está asociado con un factor provocador fuerte, ya que estos pacientes tienen un riesgo bajo de TEV recurrente, incluso cuando se identifica una trombofilia hereditaria.
Tampoco sugieren realizarlas en pacientes con TEV no provocado que ya tienen una indicación de anticoagulación a largo plazo. En los pacientes restantes con TEV no provocado y sin indicación de anticoagulación indefinida, se sugiere discutir con ellos las pruebas de trombofilia hereditaria. En la mayoría de los casos, las pruebas no cambiarán la decisión sobre la duración de la anticoagulación.
En ausencia de evidencia de alta calidad, se debe considerar la preferencia del paciente en tales decisiones. Se debe ofrecer asesoramiento genético a los pacientes sometidos a pruebas, reconociendo los efectos psicológicos que pueden tener esos resultados.
• Síndrome antifosfolípido
El síndrome antifosfolípido es una trombofilia que debe considerarse por separado. Se adquiere, por lo que la mayoría de las personas afectadas no tendrán antecedentes familiares de tromboembolismo venoso.
Se cree que el síndrome antifosfolípido está asociado con un alto riesgo de TEV recurrente y trombosis arterial. La presencia de anticuerpos antifosfolípidos persistentemente elevados con un primer TEV es una indicación aceptable para la duración indefinida de la anticoagulación. El diagnóstico de síndrome antifosfolípido se realiza sobre la base de criterios de laboratorio y clínicos.
Los criterios de laboratorio incluyen la presencia de al menos un anticuerpo asociado en dos o más ocasiones y con al menos 12 semanas de diferencia: anticoagulante lúpico, anti-β2-glicoproteína I (>percentil 99 de los controles), o anticuerpos anti-cardiolipina (> 40 unidades GPL o >percentil 99 de los controles).
Los criterios clínicos incluyen uno o más episodios de trombosis arterial, venosa o de vasos pequeños o una o más morbilidades definidas del embarazo. En los pacientes que presentan un episodio de TEV no provocado, el 6% de los pacientes en general y hasta el 19% de los menores de 50 años cumplirán los criterios para el síndrome antifosfolípido. La identificación del síndrome antifosfolípido puede ser importante para orientar las decisiones sobre la elección del tratamiento anticoagulante.
Dada la alta prevalencia del síndrome antifosfolípido entre los pacientes menores de 50 años con TEV no provocado y las implicaciones para la duración y la elección de la anticoagulación, se debe considerar la detección del síndrome antifosfolípido en estos pacientes.
Se necesitan más estudios para determinar la eficacia de los ACOD en el síndrome antifosfolípido de bajo riesgo. Los autores sugieren el uso de antagonistas de la vitamina K (AVK) sobre otras terapias en la mayoría de los pacientes con síndrome antifosfolípido asociado a anticoagulante lúpico y serología triple positiva.
• Diagnóstico de tromboembolismo pulmonar recurrente
Los pacientes que tienen antecedentes de TVP previa o embolia pulmonar tienen un riesgo mayor de por vida de eventos recurrentes. La anticoagulación reduce la incidencia de TEV recurrente en aproximadamente un 80-85%.
Sin embargo, los pacientes suelen presentar síntomas de TVP recurrente y embolia pulmonar, y diferenciar los síntomas relacionados con las complicaciones crónicas del tromboembolismo venoso, como el síndrome postrombótico y el síndrome post embolismo pulmonar, representa un desafío diagnóstico.
Debido a que el antecedente de TEV previo es una variable en algunas puntuaciones de probabilidad clínica (tabla 1), estos pacientes a menudo se clasifican como de alta probabilidad, lo que requiere imágenes de diagnóstico. Además, la concentración de dímero D permanece elevada en muchos pacientes después de completar un ciclo de tratamiento estándar para el TEV agudo, lo que limita su utilidad para excluir eventos recurrentes.
En un análisis de subgrupos combinado de estudios observacionales, los pacientes con antecedentes de TEV y embolia pulmonar clínicamente sospechada fueron tratados de forma segura utilizando un enfoque de diagnóstico de probabilidad clínica y dímero D. Sin embargo, solo el 16% (en comparación con el 33% de los que no tenían antecedentes de tromboembolismo venoso) pudo excluir la embolia pulmonar sin pruebas de imagen.
Dado que los defectos residuales a menudo persisten en la CTPA y las gammagrafías pulmonares de ventilación-perfusión de 6 a 12 meses después del diagnóstico inicial, la interpretación de las imágenes de diagnóstico para los eventos sospechosos de recurrencia requiere una comparación prudente con las imágenes anteriores para evitar el sobrediagnóstico. La tasa de resolución completa en las imágenes de línea de base varía de aproximadamente el 50% al 84%. Es difícil diferenciar la embolia pulmonar aguda de los trombos residuales y el acuerdo entre los observadores es deficiente.
Se recomienda la disponibilidad y revisión cuidadosa con un radiólogo experimentado de imágenes previas e idealmente imágenes de referencia realizadas de 6 a 12 meses después de un TEP agudo cuando se evalúa a un paciente por TEP recurrente y se ha demostrado que es un enfoque seguro y preciso.
Aunque este puede no ser un enfoque ampliamente adoptado, el riesgo de exposición a la radiación con gammagrafías pulmonares de ventilación-perfusión es bajo y se ha demostrado que la disponibilidad de tales imágenes de referencia mejora la interpretación de las pruebas de diagnóstico para la sospecha de TEV recurrente.
Tratamiento inicial del TEP
• Evaluación del riesgo de TEP
La embolia pulmonar sigue siendo una condición heterogénea, que va desde la presentación con muerte súbita hasta hallazgos incidentales sin síntomas. La inestabilidad hemodinámica inicial, definida como presión arterial sistólica por debajo de 90 mm Hg durante 15 minutos o más, es un marcador importante de pronóstico.
Sin embargo, esta presentación es infrecuente, encontrándose solo en el 5% de los casos; la mortalidad a corto plazo supera el 15%. Para el 95% restante de los casos, se han propuesto varias puntuaciones de predicción del riesgo para estimar el riesgo de un resultado adverso (tabla 2).
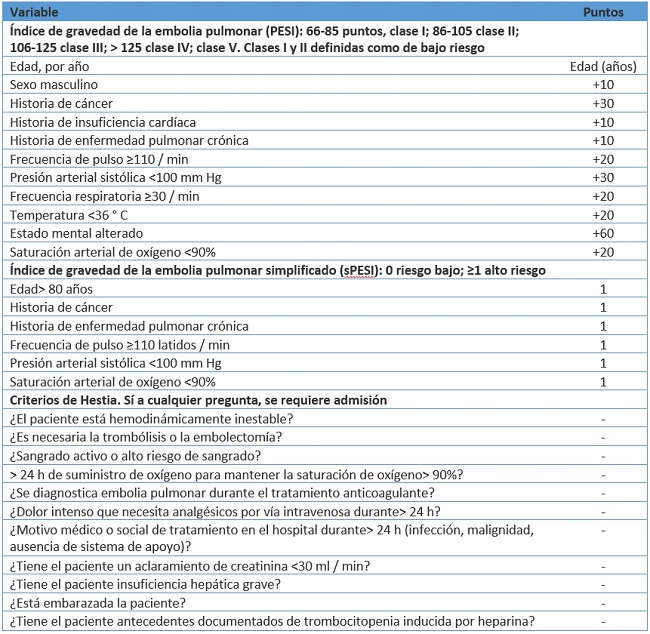 Tabla 2. Comparación de las puntuaciones de predicción del riesgo de TEPBasándose en una revisión sistemática que evaluó las características y la calidad de las puntuaciones de predicción del riesgo de embolia pulmonar, el índice de gravedad de la embolia pulmonar (PESI) y el PESI simplificado (sPESI) tuvieron la evidencia y la validación más sólidas.
Tabla 2. Comparación de las puntuaciones de predicción del riesgo de TEPBasándose en una revisión sistemática que evaluó las características y la calidad de las puntuaciones de predicción del riesgo de embolia pulmonar, el índice de gravedad de la embolia pulmonar (PESI) y el PESI simplificado (sPESI) tuvieron la evidencia y la validación más sólidas.
Ambas puntuaciones de predicción de riesgo pudieron diferenciar entre un riesgo bajo y alto de mortalidad a 30 días en pacientes con TEP. También se han estudiado biomarcadores. Una revisión sistemática mostró que en pacientes clasificados como de bajo riesgo por la puntuación PESI o sPESI, la presencia de una troponina positiva tenía una probabilidad combinada cinco veces mayor de mortalidad a los 30 días, aunque el amplio intervalo de confianza arroja dudas sobre la fiabilidad de esta estimación.
Se han propuesto otros marcadores de pronóstico para la estratificación del riesgo, incluido el péptido natriurético de tipo B y el péptido natriurético de tipo N-terminal pro-b (NT-proBNP). La evidencia de disfunción ventricular derecha por ecocardiografía y CTPA también son indicadores de peor pronóstico.
Aunque la opinión sobre su utilidad es divergente, las imágenes del ventrículo derecho y los biomarcadores cardíacos pueden considerarse para seleccionar a los pacientes que necesitan monitorización cardíaca, si no se dispone de un seguimiento estrecho.
• Tratamiento ambulatorio versus hospitalario del TEP agudo
La estratificación del riesgo se ha utilizado para identificar a los pacientes con un bajo riesgo de mortalidad a corto plazo para seleccionarlos para el tratamiento ambulatorio. La disponibilidad de ACOD ha simplificado el tratamiento ambulatorio de la embolia pulmonar porque algunos ACOD no requieren la autoadministración inicial de terapias parenterales.
Los ECA han comparado el manejo ambulatorio versus hospitalario de la embolia pulmonar y no encontraron diferencias en los resultados en pacientes seleccionados. No se observaron diferencias significativas en el resultado primario de la incidencia de TEV recurrente a los tres meses en pacientes ambulatorios versus pacientes hospitalizados. Los criterios de Hestia (tabla 2) se han combinado con troponina cardíaca y NT-proBNP, sin que se observe ningún beneficio adicional de ninguno de los marcadores en comparación con los criterios de Hestia solos.
Un ECA de 114 pacientes con embolia pulmonar de bajo riesgo, sin criterios de Hestia y una troponina negativa informó una reducción en el resultado primario de tiempo pasado en el hospital por TEV o eventos hemorrágicos 30 días después de la aleatorización.
Basados en esta y otras evidencias, los autores apoyan las recomendaciones para el manejo ambulatorio del tromboembolismo pulmonar; la identificación y el tratamiento ambulatorio de las embolias pulmonares adecuadas representarán un ahorro de costos significativo sin comprometer la seguridad del paciente.
• Tromboembolismo pulmonar subsegmentario
El mayor uso y sensibilidad de CTPA ha visto un aumento de émbolos pulmonares únicos o múltiples aislados en las arterias pulmonares subsegmentarias más pequeñas. A pesar de este aumento, la mortalidad general relacionada con la embolia pulmonar no ha cambiado, y esto puede explicar la disminución de la letalidad. La importancia clínica de la embolia pulmonar subsegmentaria sigue siendo incierta, y las recomendaciones se extrapolan principalmente de ensayos históricos de gammagrafía pulmonar de ventilación-perfusión.
En el estudio PIOPED, el 17% de los pacientes tenían defectos aislados en las arterias pulmonares subsegmentarias, lo que corresponde a una gammagrafía pulmonar de ventilación-perfusión de “baja probabilidad”. En estudios observacionales, estos pacientes de baja probabilidad no fueron tratados si se realizaron una ecografía de compresión bilateral de miembros inferiores y una ecografía de compresión en serie. Se demostró que esta es una estrategia segura y sigue siendo el tratamiento actual de estos pacientes.
El diagnóstico de TEP subsegmentario se complica por la escasa concordancia entre los observadores y el reconocimiento de que muchas embolias pulmonares subsegmentarias son interpretadas como falsos positivos por radiólogos experimentados. Esto ha llevado a la recomendación de que el TEP subsegmentario en ausencia de TVP puede no necesitar ser tratado con anticoagulación.
Los autores sugieren por ende que el TEP subsegmentario aislado en CTPA, en ausencia de cáncer o características de alto riesgo como una reserva cardiopulmonar pobre, puede abordarse como lo haría con una gammagrafía pulmonar de ventilación-perfusión no diagnóstica: con ecografía de compresión bilateral de miembro inferior basal y seriada y ningún tratamiento anticoagulante a menos que se detecte TVP.
• Elección de la anticoagulación para el TEP agudo
La terapia de anticoagulación para el TEP agudo confirmada es el pilar del tratamiento y se puede dividir en tres fases: fase inicial de cero a siete días, terapia a largo plazo de una semana a tres meses y terapia prolongada de tres meses en adelante/indeterminada. El recuadro 2 muestra las opciones de anticoagulación y la dosificación durante cada fase.
La anticoagulación parenteral con heparina de bajo peso molecular (HBPM), fondaparinux o heparina intravenosa no fraccionada se usa típicamente en pacientes ingresados ??en el hospital para el tratamiento inicial de la embolia pulmonar. Los pacientes estables al alta del hospital o aquellos pacientes aptos para tratamiento ambulatorio desde el momento del diagnóstico de embolia pulmonar aguda pueden ser tratados con ACOD.
Los ACOD se administran en dosis fijas y no requieren un control de laboratorio de rutina (tabla 3). Cada ACOD se ha considerado no inferior a la combinación AVK / HBPM en ECA de fase III para la prevención de El TEV recurrente sintomática en pacientes con tromboembolia venosa aguda). Los ACOD también tienen significativamente menos episodios hemorrágicos importantes en comparación con los AVK (tabla 4).
Las limitaciones de estos ensayos incluyen poblaciones heterogéneas y la falta de comparaciones directas entre los ACOD. Está en curso un ECA que compara rivaroxabán y apixabán para pacientes con TEV agudo, que evalúa las diferencias en el sangrado clínicamente relevante con estos anticoagulantes.
Hasta la última década, los AVK eran los únicos anticoagulantes orales disponibles para el tratamiento del TEV, utilizados simultáneamente con la anticoagulación parenteral durante al menos cinco días y hasta que dos lecturas consecutivas de la razón internacional normalizada estén entre 2 y 3. Aunque el uso de AVK ha disminuido con la disponibilidad y la relativa simplicidad de los ACOD, siguen siendo una parte fundamental del tratamiento de la embolia pulmonar en pacientes con insuficiencia renal grave, síndrome antifosfolípido, o incapacidad para cubrir el costo de los ACOD.
• Tratamiento del TEP asociado al cáncer
Los pacientes con cáncer tienen un riesgo siete veces mayor de TEV, con un riesgo absoluto general del 7% durante el primer año de un diagnóstico de cáncer y hasta un 20% según el tipo de cáncer y los tratamientos utilizados. La embolia pulmonar puede ser sintomática o encontrarse incidentalmente en las imágenes para evaluar la respuesta al tratamiento del cáncer. Las embolias pulmonares sintomáticas o incidentales tienen un riesgo similar de recurrencia.
Las complicaciones hemorrágicas graves también son más comunes con el TEV en pacientes con cáncer. El tratamiento de la embolia pulmonar aguda sintomática e incidental se individualiza de acuerdo con el riesgo de embolia pulmonar recurrente y hemorragia. El uso prolongado de HBPM dominó el campo del TEV asociado al cáncer durante mucho tiempo.
Desde entonces, cuatro ECA han comparado ACOD y HBPM en pacientes con TEV asociado al cáncer. El ECA HOKUSAI VTE Cancer mostró que edoxabán (después de cinco días con HBPM) no era inferior a la HBPM para el resultado primario de TEV recurrente o hemorragia mayor durante los 12 meses siguientes. Se observó una tasa de TEV más baja no significativa, pero la tasa de hemorragia mayor fue significativamente mayor en pacientes tratados con edoxabán. Los episodios hemorrágicos graves se observaron principalmente en el subgrupo de pacientes con neoplasias malignas del tracto gastrointestinal superior.
Un segundo ECA, SELECT-D, comparó rivaroxabán y HBPM para el tratamiento agudo del TEV asociado al cáncer. La tasa acumulada de recurrencia de TEV a los seis meses fue del 11% (7% a 16%) para dalteparina y del 4% (2% a 9%) para rivaroxaban, con menos TEV recurrentes en pacientes tratados con rivaroxabán. Desafortunadamente, el reclutamiento lento en el ensayo piloto SELECT-D resultó en una incapacidad para comparar definitivamente la eficacia y seguridad de rivaroxaban y HBPM.
Dos ECA compararon apixaban y HBPM para el tratamiento del TEV asociado al cáncer. El ensayo ADAM VTE comparó apixabán y HBPM durante seis meses de tratamiento. La trombosis recurrente fue más común en el grupo de HBPM. No se observaron diferencias en los resultados de seguridad de hemorragia mayor o tasas de hemorragia no mayor clínicamente relevantes al 6% en cada grupo.
El ensayo CARAVAGGIO asignó al azar a 1.170 pacientes a apixabán o HBPM durante seis meses de tratamiento. El apixabán no fue inferior a la HBPM para el resultado primario de TEV recurrente durante el período de prueba de seis meses. No se observaron diferencias en la hemorragia mayor, el principal resultado de seguridad.
El consenso de expertos clínicos canadienses proporciona un algoritmo de tratamiento para pacientes con cáncer y TEV agudo, considerando el riesgo de hemorragia, las preferencias informadas del paciente y el reembolso de los medicamentos (fig. 3). Esta declaración de consenso se realizó antes de la publicación de los ensayos ADAM VTE y CARAVAGGIO, cuyos resultados también apoyarían al apixabán para el tratamiento del TEV asociado al cáncer.
En general, los pacientes con embolia pulmonar asociada a cáncer sin contraindicación para la anticoagulación se evalúan para el riesgo de hemorragia sobre la base de antecedentes de hemorragia, comorbilidades y tipo de malignidad. Las interacciones fármaco-fármaco son otra consideración, especialmente para los ACOD. Todos los ACOD son sustratos de la glicoproteína P; apixaban y rivaroxaban también son sustratos del citocromo P450 (CYP3A4), mientras que edoxabán y dabigatrán no lo son.
La determinación de interacciones medicamentosas clínicamente relevantes es compleja en pacientes con cáncer, ya que a menudo se tratan con muchas terapias contra el cáncer que pueden competir por una vía metabólica común. La elección del anticoagulante debe hacerse de forma individual y en consulta con un farmacéutico para evaluar las interacciones fármaco-fármaco.
• Tratamiento de la embolia pulmonar asociada al embarazo
Los ACOD y el fondaparinux atraviesan la placenta y deben evitarse durante el embarazo. La heparina no fraccionada y la HBPM son más seguras durante el embarazo ya que no atraviesan la placenta; la HBPM es el pilar del tratamiento debido a su dosificación una vez al día y la autoadministración por vía subcutánea.
El manejo de la anticoagulación en el momento del parto requiere una estrecha coordinación con un equipo multidisciplinario de obstetricia, anestesia, hematología y medicina materno-fetal. Un ECA reciente de 3.062 embarazos de bajo riesgo mostró que la inducción programada del trabajo de parto es segura, no aumenta el riesgo de parto por cesárea y tuvo un pequeño beneficio en el resultado primario de muerte perinatal o complicaciones neonatales graves.
En pacientes con un evento de TEV agudo en el embarazo actual que ocurrió más de un mes antes de la fecha de parto prevista, los autores sugieren una inducción programada del trabajo de parto con la última dosis de HBPM administrada 24 horas antes. La interrupción de la HBPM 24 horas antes del parto permite el uso seguro de anestesia neuroaxial si es necesario.
En ausencia de hemorragia posparto, la HBPM se reinicia seis horas después del parto y se continúa durante al menos seis semanas posparto. En pacientes que tienen una embolia pulmonar aguda dentro de un mes del parto esperado, también sugerimos la inducción programada del trabajo de parto pero la administración de heparina no fraccionada en dosis terapéuticas hasta el trabajo de parto activo para evitar interrupciones prolongadas del tratamiento.
Si la embolia pulmonar se produjo en menos de dos semanas desde el momento del parto, se puede considerar un filtro de vena cava inferior (VCI). Las opciones de tratamiento anticoagulante posparto para las mujeres que están amamantando incluyen heparina no fraccionada, HBPM , AVK, fondaparinux o danaparoid.
Los ACOD se concentran en la leche materna y están contraindicados, pero pueden considerarse en mujeres que no están amamantando o después de completar la lactancia en aquellas que tienen una indicación de tratamiento a más largo plazo. Se recomienda la profilaxis de TEV preparto y posparto con HBPM para embarazos futuros.
• Trombólisis para el TEP agudo
La terapia trombolítica, ya sea sistémica (más común) o dirigida por un catéter en las arterias pulmonares, puede usarse para acelerar la resolución de la embolia pulmonar aguda, disminuir la presión de la arteria pulmonar y aumentar la oxigenación arterial. El 5% de los pacientes presentará compromiso hemodinámico con presión arterial sistólica persistentemente menor de 90 mm Hg, siendo el subgrupo con mayor riesgo de mortalidad temprana, por lo que son los que más se benefician de la terapia trombolítica.
El sangrado es la limitación principal las tasas de sangrado mayor son del 10% o más). Una presión arterial sistólica persistentemente menor de 90 mm Hg durante al menos 15 minutos y sin alto riesgo de hemorragia se considera una indicación para el tratamiento inmediato con terapia trombolítica sistémica (evidencia de mala calidad).
La trombólisis dirigida por catéter (TDC) es un método alternativo para la administración de trombólisis con un riesgo potencialmente menor de hemorragia (un tercio de la dosis de fármaco trombolítico en comparación con la administración sistémica). En un ECA de 59 pacientes con embolia pulmonar aguda sin evidencia de compromiso hemodinámico en la presentación, la TDC mostró un beneficio en el resultado primario de mejoría de la función ventricular derecha a las 24 horas.
Las tasas de hemorragia mayor varían entre los estudios, pero algunos informan que son similares a las de la trombólisis sistémica. El papel de la CTD sigue sin estar claro, y los autores no recomiendan su uso rutinario excepto en centros experimentados cuando un paciente tiene compromiso hemodinámico y un alto riesgo de hemorragia y la terapia puede iniciarse sin demora.
Un metanálisis en red de todos los ECA que compararon los procedimientos de recanalización para la embolia pulmonar aguda no encontró ningún beneficio significativo en la mortalidad general para ningún método de trombólisis y un riesgo significativamente mayor de hemorragia, especialmente con trombólisis sistémica de dosis completa.
Para los pacientes que presentan inestabilidad hemodinámica persistente durante al menos 15 minutos, en ausencia de evidencia de alta calidad, pero también considerando la alta mortalidad a corto plazo de este grupo, los autores sugieren el uso de trombólisis sistémica en pacientes sin contraindicación absoluta.
Para los pacientes con inestabilidad hemodinámica persistente pero con alto riesgo o con contraindicaciones para la trombólisis sistémica, los autores sugieren que la trombólisis dirigida por catéter se puede considerar para cada caso individual, cuando esté disponible. Para todos los demás pacientes considerados de alto riesgo de deterioro a corto plazo, se sugiere observación en un entorno monitoreado, con terapia trombolítica reservada para el deterioro hemodinámico.
• Embolectomía quirúrgica
La embolectomía quirúrgica con derivación cardiopulmonar se puede realizar en pacientes con embolia pulmonar aguda asociada con inestabilidad hemodinámica y contraindicación para la terapia trombolítica. Las series de casos publicadas han mostrado resultados variables, con una mortalidad perioperatoria que oscila entre el 4 y el 59%.
La edad avanzada, el paro cardíaco prequirúrgico y la terapia trombolítica prequirúrgica se asocian con peores resultados. La oxigenación por membrana extracorpórea (ECMO), ya sea sola o como puente a la embolectomía quirúrgica, también ha mostrado beneficios en informes de casos y series de casos pequeñas.
La ECMO requiere anticoagulación continua y puede inducir una coagulopatía de consumo, lo que genera un alto riesgo de hemorragia. En un paciente con inestabilidad hemodinámica significativa y contraindicación para la trombólisis, se puede considerar la embolectomía quirúrgica y/o ECMO.
• Filtros de vena cava
Los filtros IVC se introdujeron por primera vez en 1973 y se diseñaron para atrapar mecánicamente los émbolos venosos de las extremidades inferiores para prevenir el TEP. Desde entonces, el uso de filtros de VCI ha aumentado drásticamente, a pesar de la falta de evidencia de un efecto sobre la mortalidad relacionada con el TEV.
Las guías de las principales sociedades clínicas difieren en la indicación sugerida para los filtros de VCI, pero en general coinciden en su uso en pacientes con trombosis venosa profunda proximal aguda o embolia pulmonar y una contraindicación para la anticoagulación. El uso de filtros de VCI para otras indicaciones se ha expandido mucho en los últimos años, pero no está impulsado por evidencia.
La colocación preventiva de un filtro VCI permanente además de la anticoagulación estándar en pacientes de alto riesgo con TVP proximal aguda se investigó en el estudio PREPIC, un ECA de 400 pacientes, que mostró una reducción en el resultado primario de embolia pulmonar temprana diagnosticada dentro de los primeros 12 días pero ninguna diferencia en la mortalidad.
Los datos de seguimiento a más largo plazo mostraron resultados similares, con una reducción de la embolia pulmonar en el brazo del filtro de VCI, pero un aumento significativo en la TVP recurrente y sin diferencias en la mortalidad general.
Un ECA de seguimiento, PREPIC-2, estudió los filtros de VCI extraíbles en 399 pacientes con embolia pulmonar de alto riesgo y no mostró ningún beneficio en el uso del filtro combinado con anticoagulación estándar en comparación con la anticoagulación sola en el resultado primario de embolia pulmonar recurrente en tres meses.
Los autores sugieren que los filtros VCI deben restringirse a pacientes con TVP proximal aguda o embolia pulmonar en quienes no se puede administrar la anticoagulación de dosis completa debido a una hemorragia activa incontrolable o un alto riesgo de hemorragia potencialmente mortal (por ejemplo, defecto de coagulación, trombocitopenia grave, hemorragia cerebral reciente o lesión cerebral con alto riesgo de sangrado) o cirugía urgente que requiera la interrupción de la anticoagulación.
En tales pacientes, se debe evaluar con frecuencia la seguridad de iniciar o reanudar la anticoagulación. Una vez que se puede reiniciar la anticoagulación con la dosis completa sin recurrencia del sangrado mayor, el filtro de la VCI debe retirarse de inmediato para reducir la posibilidad de complicaciones relacionadas con el filtro de la VCI, que aumentan con el tiempo.
Duración del tratamiento del TEP
La duración del tratamiento depende de la presencia o ausencia de factores de riesgo en el momento del diagnóstico (ver recuadro 1). El Subcomité Científico de la ISTH sugiere evaluar el riesgo de TEV recurrente de los pacientes.
En pacientes con menos del 5% de riesgo al año o menos del 15% a los cinco años, la recomendación es suspender la anticoagulación. En el TEP provocado por factores de riesgo transitorios importantes como la cirugía mayor, el riesgo de embolia pulmonar recurrente al año es inferior al 1%, lo que favorece la interrupción de la anticoagulación a los tres meses.
En aquellos con factores de riesgo transitorios menores, como embolia pulmonar asociada a hormonas, el riesgo de TEV recurrente es aproximadamente del 15% a los cinco años y es importante considerar los riesgos de hemorragia mayor relacionada con la anticoagulación al recomendar un tratamiento prolongado en este grupo intermedio.
En pacientes sin factor de riesgo identificable (embolia pulmonar no provocada), una revisión sistemática reciente y un metanálisis de 18 estudios (ECA y estudios observacionales) evaluó el riesgo de TEV recurrente en pacientes con un primer TEV no provocado.
Los resultados sugieren que los pacientes con un primer TEV no provocado tienen un riesgo sustancial de trombosis recurrente, y esto debería orientar las decisiones sobre la terapia anticoagulante prolongada. La anticoagulación de duración intermedia, como extender el período de tratamiento inicial a uno o dos años antes de suspender la terapia, no reduce el riesgo subsiguiente de TEV recurrente después de suspender la anticoagulación.
La estratificación del riesgo para pacientes con TEV no provocado también puede ayudar a determinar el riesgo de trombosis recurrente. Marcadores de pronóstico de TEV recurrente incluyen el sexo masculino, la edad avanzada, trombofilia hereditaria, obesidad, dímero D persistentemente positivo, y obstrucción pulmonar residual en la gammagrafía pulmonar de ventilación-perfusión. Individualmente, estos factores de riesgo son insuficientes para recomendar la anticoagulación a largo plazo; sin embargo, se han propuesto modelos de predicción de riesgos que incorporan varias combinaciones.
La regla de decisión clínica más grande validada de forma prospectiva (2.785 pacientes) es "Los hombres continúan y HERDOO-2". En la cohorte de derivación de esta regla de predicción, los hombres tenían un riesgo anual de TEV recurrente del 13,9% mientras estaban sin anticoagulación, por lo que permanecieron con anticoagulación en la cohorte de validación.
Las mujeres, por otro lado, se estratificaron en grupos de riesgo, de modo que la anticoagulación podría suspenderse en mujeres con 0 o 1 puntos HERDOO (hiperpigmentación, edema o enrojecimiento de cualquiera de los miembros inferiores, dímero D> 250 μg / L, obesidad (masa corporal índice >30), mayor edad (≥65 años)).
El riesgo anual de TEV recurrente en mujeres de bajo riesgo fue del 1,6% en la cohorte de derivación y del 3% en la cohorte de validación. Las mujeres con 2 o más puntos HERDOO se consideraron de alto riesgo y tuvieron una tasa anual de TEV recurrente del 14,1% en la cohorte de derivación y permanecieron con anticoagulación en el estudio de validación. Las opciones de anticoagulantes para el tratamiento prolongado del TEV se muestran en el recuadro 2. La anticoagulación oral reduce el riesgo de TEV recurrente solo durante el tratamiento.
La identificación de pacientes con TEV índice no provocado que se beneficiarían de la anticoagulación prolongada para el tratamiento prolongado y la prevención secundaria debe equilibrarse con el riesgo de hemorragia durante la anticoagulación.
Los factores de riesgo de hemorragia incluyen edad mayor de 75 años, antecedentes de hemorragia, enfermedad hepática crónica, enfermedad renal crónica, accidente cerebrovascular previo y el uso concomitante de agentes antiplaquetarios o antiinflamatorios no esteroides. Como los riesgos de sangrado y tasas de letalidad asociados son más bajos para los ACOD que los AVK, cuando sea posible, los ACOD deben ser considerados sobre los AVK.
El recuadro 2 muestra las opciones de dosificación de ACOD para el tratamiento prolongado, incluida la continuación de la misma dosis que para el tratamiento a largo plazo o la dosis reducida de rivaroxaban y apixaban. El ECA EINSTEIN CHOICE comparó rivaroxabán 20 mg al día y rivaroxabán 10 mg al día con 100 mg de aspirina al día para el tratamiento prolongado de TEV en 3.400 participantes que completaron al menos seis a 12 meses de anticoagulación para El TEV aguda.
Para el resultado primario de eficacia de TEV recurrente / fatal, rivaroxabán se asoció con menos eventos en comparación con la aspirina. El resultado de seguridad primario de hemorragia mayor no fue diferente para ninguna de las dosis de rivaroxabán en comparación con aspirina. Las limitaciones de EINSTEIN CHOICE se centran en la población con TEV predominantemente provocado (60% de los participantes). Se desconoce si rivaroxabán 10 mg al día es tan eficaz como 20 mg al día en pacientes no seleccionados de alto riesgo con TEV no provocado.
El estudio AMPLIFY EXT RCT comparó dos dosis de apixabán, 5 mg dos veces al día y 2,5 mg dos veces al día, con placebo durante 12 meses para la prevención del TEV recurrente / mortalidad por todas las causas. El apixabán en ambas dosis resultó en menos eventos de resultado primario recurrentes en comparación con placebo.
La hemorragia mayor fue el resultado principal de seguridad y se produjo con una frecuencia similar en cada grupo de apixabán. Más del 90% de los participantes en AMPLIFY EXT tenían TEV índice no provocado, lo que les asegura que ambas dosis de apixaban reducen el riesgo de TEV recurrente en esta población de pacientes de alto riesgo. sin aumentar los episodios hemorrágicos.
Estudios en curso como RENOVE están evaluando la terapia prolongada de ACOD de dosis completa en comparación con ACOD de dosis reducida para pacientes con TEV índice no provocado. Mientras tanto, deben incorporarse las preferencias de los pacientes y la evaluación regular de los riesgos de hemorragia en las decisiones sobre la terapia prolongada. Los autores recomiendan una reevaluación anual de los riesgos de hemorragia y TEV recurrente para informar las decisiones sobre la anticoagulación prolongada.
En el TEP asociado al cáncer, el cáncer es un factor de riesgo persistente importante y se sugiere la necesidad de una terapia de anticoagulación prolongada, más allá de los seis meses, para los pacientes con cáncer activo (enfermedad metastásica) o que reciben quimioterapia.
Consecuencias a largo plazo del TEP
• Síndrome post-TEP
Hasta el 50% de los pacientes informan secuelas a largo plazo después de una embolia pulmonar. El síndrome post-TEP ha sido definido por la función subóptima cardiaca, la dinámica de flujo de la arteria pulmonar, o el intercambio de gases pulmonar en reposo o durante el ejercicio, en combinación con disnea, disminución de la tolerancia al ejercicio, o disminución del estado funcional o la calidad de vida, sin una explicación alternativa.
En el extremo, la hipertensión pulmonar tromboembólica crónica (HPTEC) ocurre en aproximadamente el 3% de los pacientes que sobreviven después de un período de tratamiento de seis meses por embolia pulmonar aguda. Se desconoce la fisiopatología exacta de por qué ocurre la HPTEC en una minoría de pacientes.
Los factores de riesgo para el desarrollo de HPTEC después de una embolia pulmonar aguda incluyen retraso en el diagnóstico, alta carga de trombos, TEP sintomático recurrente, hipertensión pulmonar o disfunción del ventrículo derecho al inicio del estudio y no lograr la resolución del trombo. El diagnóstico de HPTEC se confirma al mostrar una presión arterial pulmonar media superior a 25 mm Hg combinada con obstrucciones vasculares pulmonares trombóticas.
La exploración pulmonar de ventilación-perfusión plana es la modalidad de imagen preferida, con una alta sensibilidad y especificidad para la HPTEC. La endarterectomía pulmonar bilateral a través de la capa medial de las arterias pulmonares es un tratamiento curativo para la HPTEC, pero la mayoría de los pacientes necesitan anticoagulación de por vida debido al riesgo de TEV recurrente.
Un segundo subconjunto de pacientes son aquellos con evidencia de enfermedad tromboembólica crónica sin hipertensión pulmonar. Las pruebas funcionales cardiopulmonares sugieren que este es un fenotipo clínico intermedio en respuesta al ejercicio. Un estudio observacional (ELOPE) siguió a 100 pacientes con TEP agudo y realizó una prueba de esfuerzo cardiopulmonar al mes ya los 12 meses.
De acuerdo con los síntomas autoinformados al año, casi el 50% de estos pacientes tenían evidencia de disminución de la capacidad de ejercicio. La reducción de la capacidad de ejercicio cardiopulmonar observada se correlacionó bien con varias mediciones de la calidad de vida y la prueba de caminata de seis minutos.
La obstrucción pulmonar residual inicial no se asoció con la limitación del ejercicio, ni tampoco las pruebas de función pulmonar o los resultados ecocardiográficos. Los predictores de las limitaciones del ejercicio fueron la edad, el índice de masa corporal y los antecedentes de tabaquismo.
La ausencia de asociación con la carga de coágulos residuales basales y la capacidad de ejercicio cardiopulmonar también es consistente con el estudio de seguimiento a largo plazo de pacientes con embolia pulmonar que tuvieron trombólisis sistémica, ya que no se observó ningún beneficio en la disnea o la capacidad de ejercicio informadas.
El síndrome post-embolia pulmonar describe una consolidación heterogénea de síntomas y hallazgos objetivos que tiene un efecto importante en la calidad de vida de los pacientes con embolia pulmonar. Se recomienda el seguimiento de los pacientes más allá del período de embolia pulmonar aguda y la detección de disnea persistente y limitaciones funcionales a los tres a seis meses. Se evaluan a todos los pacientes que informan disnea persistente con una gammagrafía pulmonar de ventilación-perfusión para evaluar defectos persistentes no coincidentes y ecocardiograma transtorácico para hipertensión pulmonar. Se puede ofrecer rehabilitación cardiopulmonar dirigida y modificaciones en el estilo de vida a los pacientes restantes, aunque se necesitan investigaciones futuras para determinar los beneficios de dichos programas.
• Impacto psicológico y calidad de vida
El diagnóstico de una embolia pulmonar tiene un efecto psicológico significativo en los pacientes, que a menudo se refieren a tal evento como una experiencia cercana a la muerte. El estudio ELOPE descrito anteriormente siguió a una cohorte de pacientes con embolia pulmonar aguda durante un año y mostró una disminución aguda en las puntuaciones de calidad de vida, pero estas puntuaciones luego mejoraron durante el seguimiento de un año. Las entrevistas cualitativas a pacientes de 6 a 12 meses después de un diagnóstico de TEV informaron un “cambio de vida y cambio para siempre” al describir su experiencia vivida con tromboembolismo venoso. Algunos pacientes también notaron un "pánico postrombótico", que describe sentimientos de hipervigilancia y pánico relacionados con el miedo a la recurrencia de la enfermedad. Es evidente que existe la necesidad de un mayor reconocimiento del bienestar psicológico de los pacientes y de la investigación de posibles apoyos específicos.
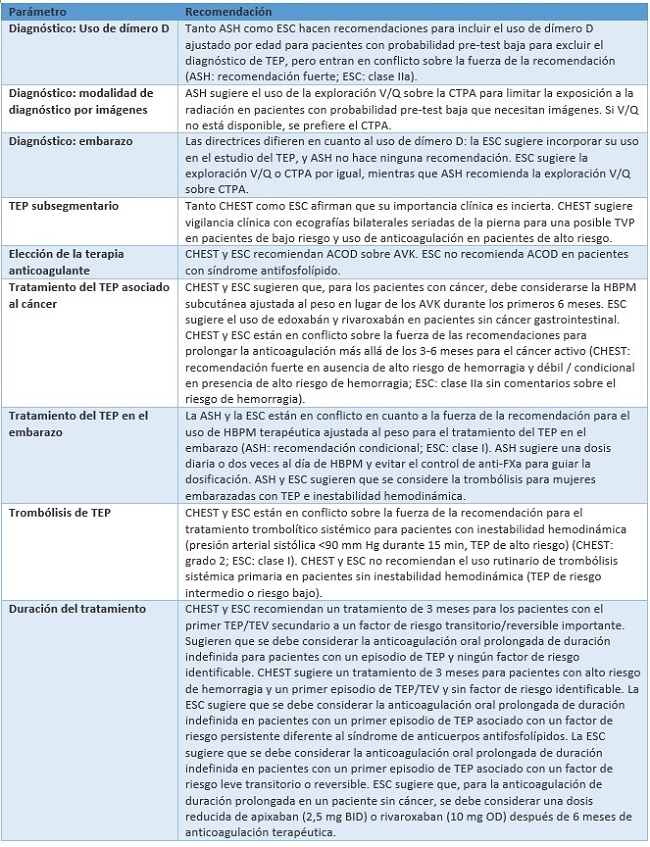
Directrices
En siguiente tabla se resumen las guías que parecen ser las más relevantes, actualizadas y avaladas por las principales sociedades internacionales en lo que respecta al manejo de pacientes con embolia pulmonar.
Tratamientos emergentes
Las terapias anticoagulantes dirigidas a los factores de coagulación IX, XI y XII se encuentran en investigación y desarrollo. De estos, la inhibición del factor XIa es la más desarrollada. Büller et al asignaron al azar a 300 pacientes a 200 mg o 300 mg de FXI-ASO, administrados como una serie de inyecciones subcutáneas durante 36 días antes de la operación, o profilaxis con enoxaparina.
El régimen de 200 mg no fue inferior y el régimen de 300 mg fue superior a la enoxaparina (P <0,001). Weitz et al asignaron al azar a 813 pacientes después de una artroplastia de rodilla electiva a enoxaparina, apixaban o infusiones intravenosas únicas del inhibidor del factor XIa osocimab en varias dosis y horarios (preoperatorio / postoperatorio).
Las dosis de osocimab de 0,6 mg/kg, 1,2 mg/kg y 1,8 mg/kg administradas postoperatoriamente cumplieron los criterios de no inferioridad en comparación con enoxaparina para el resultado primario de nuevo TEV (sintomático o asintomático), y la dosis preoperatoria de 1,8 mg/kg de osocimab cumplió los criterios de superioridad en comparación con la enoxaparina. Se necesitan más estudios para determinar la verdadera eficacia y el riesgo de hemorragia de estos nuevos anticoagulantes.
El tromboembolismo venoso, que incluye trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP), es el tercer trastorno cardiovascular más común y afecta hasta al 5% de la población durante su vida. La mayor sensibilidad de las modalidades de diagnóstico por imágenes ha más que duplicado las tasas de ingreso hospitalario por embolia pulmonar en los últimos 10 años, aunque la tasa de letalidad se ha mantenido estable o disminuido.
Se cree que la embolización de una TVP en la extremidad inferior hacia las arterias pulmonares es el mecanismo más común de embolia pulmonar. Los estudios de registro encontraron que hasta el 17% de los pacientes mueren dentro de los tres meses posteriores al diagnóstico de tromboembolismo venoso, aunque muchas de estas muertes pueden deberse a comorbilidades asociadas más que a una causalidad directa.
En los grandes ensayos controlados aleatorios (ECA) más recientes, la mortalidad por todas las causas a los tres meses ha sido aproximadamente del 2%.Se necesita una evaluación clínica cuidadosa para el diagnóstico de embolia pulmonar, ya que la presentación puede simular otras afecciones médicas comunes. Las puntuaciones de probabilidad clínica en combinación con la prueba del dímero D mejoran el uso y la interpretación de las imágenes de diagnóstico. El uso de la interpretación del dímero D ajustada por probabilidad clínica o ajustada por edad ha sido un importante avance en el diagnóstico de embolia pulmonar.
Varios scores de predicción de riesgo, biomarcadores séricos y anomalías en las imágenes, como la distensión ventricular derecha, pueden identificar a los pacientes con mayor riesgo a corto plazo de mortalidad por todas las causas. Esta revisión está dirigida a los médicos que atienden a pacientes con embolia pulmonar y a los investigadores interesados en los avances recientes en su tratamiento.
Epidemiología
La incidencia anual del TEP en la población es de 1 por 1.000 personas, pero aumenta drásticamente con la edad, de 1,4 por 1.000 personas de 40 a 49 años a 11,3 por 1000 de 80 años o más. El tromboembolismo venoso (TEV) recurrente ocurre en el 30% de las personas, lo que hace que la tasa de ataque (incluido el TEV incidente y recurrente) sea más alta, estimada en hasta 30 por 1000 personas-año.
La influencia de la raza en la incidencia de TEV es incierta, pero la incidencia puede ser mayor en poblaciones blancas y afroamericanas y menor en asiáticos y nativos americanos. En general, la incidencia en hombres es ligeramente mayor que en mujeres, pero el equilibrio cambia según las categorías de edad. Entre las mujeres menores de 45 años o mayores de 80 años, la incidencia de TEV es mayor que en los hombres.
El 50% de los episodios de TEV están asociados con un factor de riesgo transitorio, como una cirugía reciente o el ingreso hospitalario por una enfermedad médica y el 20% están asociados con el cáncer.
A pesar de la literatura exhaustiva sobre epidemiología y factores de riesgo, la conciencia pública es escasa en comparación con otras afecciones de salud con una incidencia comparable. Esto quedó ilustrado en una encuesta internacional a más de 7.000, donde la mitad de los encuestados no tenía conocimiento de las condiciones y factores de riesgo del tromboembolismo venoso, y menos del 30% conocía sus signos y síntomas.
| Recuadro 1. Factores de riesgo transitorios de trombosis venosa Factor de riesgo fuerte (razón de posibilidades> 10)
|
Fuentes y criterios de selección
Se realizaron búsquedas en Ovid Medline, Cochrane CENTRAL y otras citas no indexadas desde el 1 de enero de 2010 hasta el 7 de agosto de 2019 para encontrar revisiones sistemáticas, metanálisis y ensayos controlados aleatorizados en inglés que evaluaran el tratamiento de la embolia pulmonar; incluimos guías de práctica clínica.
Se usaron Ovid Medline y PubMed para estrategias de búsqueda dedicadas de temas seleccionados que se creía que no estaban incluidos en la búsqueda anterior. Estos temas incluyeron filtros de la vena cava inferior, sangrado y anticoagulación, síndrome postrombótico, síndrome postrombótico, hipertensión pulmonar tromboembólica crónica, calidad de vida y experiencia del paciente, cáncer, trombofilia hereditaria y síndrome antifosfolípido.
Al final, se incluyeron 11 guías de práctica clínica/declaraciones de consenso aprobadas, 24 revisiones sistemáticas / metanálisis, 25 ensayos aleatorizados, 39 estudios prospectivos y 21 estudios de análisis retrospectivos / secundarios informaron nuestra descripción general.
También se incluyeron seis ensayos clínicos de reclutamiento activo; después de que se aceptara esta revisión para su publicación, se completó uno de estos ensayos clínicos (CARAVAGGIO), y se publicaron sus resultados; los autores actualizaron entonces el manuscrito para incluir los detalles de este ensayo y sus resultados.
Diagnóstico
Es necesario el reconocimiento rápido de una constelación de signos y síntomas inespecíficos para el diagnóstico de TEP. Es prudente iniciar de inmediato la anticoagulación mientras se esperan resultados de las pruebas debido al alto riesgo de mortalidad temprana con embolia pulmonar no tratada.
Aunque este enfoque para iniciar la anticoagulación en pacientes en los que se sospecha una embolia pulmonar ha demostrado ser seguro en entornos ambulatorios, persisten los riesgos de hemorragia y uso excesivo de pruebas de diagnóstico. Proceder de manera inapropiada también puede distraer a los médicos de identificar las causas alternativas de los síntomas.
• Escalas de predicción clínica
Las escalas de predicción clínica se pueden utilizar para asignar una probabilidad pre-test de embolia pulmonar. La consideración de la probabilidad pre-test evita pruebas innecesarias y es fundamental para la interpretación de los resultados. Las de Ginebra y Wells se encuentran entre las escalas de predicción clínica más comúnmente citadas.
Tanto el puntaje de Ginebra como el de Wells se han estudiado en más de 55.000 pacientes y se ha demostrado que son fiables, precisas y superiores a una evaluación clínica no estandarizada. Existe una adaptación del score de Wells, que mantiene solo tres elementos (signos clínicos de TVP, hemoptisis y si la embolia pulmonar es el diagnóstico más probable), la escala YEARS.
A pesar del uso rutinario de escalas de probabilidad clínica, solo el 8% de los pacientes en los EE.UU. y el 27% en Europa investigados por TEP tendrán el diagnóstico confirmado. Para superar esto, los criterios de descarte de embolia pulmonar (regla PERC) se estudiaron en un ensayo de 1.916 pacientes.
La regla PERC consta de ocho puntos o variables clínicas (hipoxia, edema unilateral del miembro inferior, hemoptisis, TEV previo, cirugía o traumatismo reciente, edad> 50 años, uso de hormonas, taquicardia) y no se realizaron pruebas adicionales (dímero D y / o imágenes) si las ocho variables estuvieran ausentes.
Este estudio mostró que en los pacientes considerados con muy bajo riesgo de embolia pulmonar por gestalt, la regla PERC no fue inferior a la atención estándar para el resultado primario de la tasa de TEV durante tres meses de seguimiento (diferencia media 0,2, límite de confianza superior del 95% unilateral 1,6%). La regla PERC no debe aplicarse a pacientes con mayor riesgo de embolia pulmonar, definida como una probabilidad pre-test de embolia pulmonar superior al 15%.

Tabla 1. Comparación de las puntuaciones de probabilidad clínica de TEP
• Prueba de dímero DFisiológicamente, la activación de la coagulación y la generación de fibrina reticulada conducen simultáneamente a la activación de la fibrinólisis. El dímero D es un producto de degradación de la fibrinólisis y aumenta en pacientes con TEV agudo y otros trastornos no trombóticos.
El dímero D es una herramienta de diagnóstico útil, y un valor negativo en combinación con una probabilidad clínica baja es útil para excluir un diagnóstico de tromboembolismo venoso.
El dímero D no debe utilizarse como herramienta de detección en pacientes en los que no se sospecha clínicamente de TEV. Los médicos deben evaluar la probabilidad clínica pre-test de embolia pulmonar antes de solicitar la prueba del dímero D, ya que el conocimiento de los resultados del dímero D puede influir en la evaluación de la probabilidad clínica.
El dímero D es una prueba de diagnóstico sensible pero no específica.Se pueden realizar mejoras en la especificidad utilizando un valor de corte dicotomizado de acuerdo con la probabilidad pre-test. En un estudio, por ejemplo, un punto de corte de 1000 ng/ml en pacientes con una probabilidad clínica pre-test baja y 500 ng/ml en pacientes con probabilidad clínica moderada permitió excluir con seguridad la embolia pulmonar sin la necesidad de imágenes de diagnóstico adicionales (aquellos de probabilidad clínica alta si se sometieron a diagnóstico por imagen). En este estudio, ningún paciente con una puntuación de probabilidad clínica baja o moderada tuvo un evento de TEV recurrente en los tres meses de seguimiento del estudio.
Alternativamente, las concentraciones de dímero D aumentan con la edad y la especificidad se puede mejorar con un valor de corte ajustado por edad, como por ejemplo los utilizados por un estudio observacional (valor de corte de 500 µg/l para pacientes ≤50 o edad × 10 µg/l para pacientes >50 años). En ese estudio, la tasa de TEV a los tres meses en pacientes con una concentración de dímero D superior a 500 μg/l pero por debajo del valor de corte ajustado por edad fue de 1 en 331 pacientes (0,3%, 0,1% a 1,7%).
• Imágenes por sospecha de TEP
Históricamente, la prueba diagnóstica de referencia para la embolia pulmonar ha sido la angiografía pulmonar; este procedimiento invasivo se ha abandonado en gran medida. Las gammagrafías pulmonares de ventilación-perfusión y la angiografía pulmonar por tomografía computarizada (CTPA) son pruebas de imagen validadas.
Ambos deben usarse en combinación con los scores de probabilidad y la prueba del dímero D para interpretar con precisión los resultados, ya que se pueden observar resultados falsos negativos y falsos positivos cuando los resultados de la prueba no coinciden con las puntuaciones de probabilidad clínica (figura 2).
Un CTPA normal se asocia con una incidencia combinada de TEV a los tres meses del 1,2% (0,8% al 1,8%) y un valor predictivo negativo del 98,8% (98,2% a 99,2%). Una gammagrafía pulmonar de ventilación-perfusión en un algoritmo de diagnóstico validado funciona igual de bien que la CTPA.
Los pacientes con embolia pulmonar excluidos por un algoritmo de diagnóstico que combina exploración pulmonar de ventilación-perfusión, dímero D, ecografía por compresión y score de probabilidad clínica tuvieron una incidencia de TEV a los tres meses del 0,1% (0,0% a 0,7%) con un valor predictivo negativo de 99,5% (99,1% a 100%).
Un ECA que comparó la CTPA y la gammagrafía pulmonar de ventilación-perfusión encontró que la CTPA detectó un 5% (1,1% a 8,9%) más de embolias pulmonares, pero los pacientes en los que se excluyó la embolia pulmonar mediante un algoritmo de diagnóstico basado en la gammagrafía pulmonar de ventilación-perfusión no tenían una mayor incidencia de TEV a tres meses durante el seguimiento. No obstante, la amplia disponibilidad, la menor cantidad de resultados no diagnósticos y la capacidad de proporcionar diagnósticos alternativos han convertido a la CTPA en la modalidad de diagnóstico más común.
Sin embargo, las importantes limitaciones, como la exposición a la radiación ionizante y el riesgo de malignidad secundaria, toxicidad renal en pacientes con enfermedad renal preexistente, y el riesgo de sobre-diagnóstico y tratamiento excesivo de embolia pulmonar clínicamente insignificante, puede hacer que los médicos reevalúen la elección de este método. Sobre la exploración con tomografía computarizada por emisión de fotón único (SPECT), los autores sugieren favorecer la prueba de ventilación-perfusión ya que la técnica y los criterios de diagnóstico del SPECT son variables y no se han validado lo suficiente.
• Diagnóstico de TEP en el embarazo
El embarazo y el período posparto confieren un mayor riesgo de TEV, pero solo al 4-7% de las mujeres investigadas se les diagnostica un TEP asociado al embarazo. El diagnóstico es un desafío, ya que la dificultad para respirar y la hinchazón de las extremidades inferiores son quejas comunes y la concentración de dímero D aumenta en embarazos normales.
Un estudio observacional de 510 mujeres embarazadas aplicó la escala YEARS y el dímero D con un punto de corte estratificado (1000 ng/ml si no se cumplieron los criterios o 500 ng/ml si se cumplieron uno o más criterios). La ecografía de compresión se realizó solo en mujeres con síntomas de TVP. Con este enfoque, el 39% de las mujeres pudieron evitar las imágenes de diagnóstico, con una incidencia de TEV de tres meses aceptablemente baja de 0,21% (0,04% a 1,2%). El algoritmo YEARS adaptado al embarazo parece ser seguro y eficaz para reducir la necesidad de diagnóstico por imágenes en algunas pacientes.
Las opciones de diagnóstico por imagen para la sospecha de TEP durante el embarazo son similares a las de las pacientes no embarazadas. Tanto las gammagrafías pulmonares de ventilación-perfusión como la CTPA son modalidades de diagnóstico por imágenes seguras y precisas durante el embarazo. La exposición fetal a la radiación está muy por debajo de los límites aceptables para ambas pruebas. Dada la edad más joven, y por lo tanto el riesgo de por vida más largo de neoplasias malignas secundarias, los autores sugieren el uso de gammagrafías pulmonares de ventilación-perfusión en mujeres embarazadas.
La ecografía de compresión como primera prueba se puede considerar en pacientes que tengan síntomas que sugieran TVP. La ausencia de TVP no excluye la necesidad de imágenes de tórax, pero si se confirma una TVP proximal, se puede hacer un diagnóstico presuntivo de embolia pulmonar sin imágenes específicas.
• Prueba de trombofilia
Los antecedentes familiares de TEV presagian un mayor riesgo, particularmente cuando el TEV no es provocado o el paciente es menor de 50 años. A pesar de esto, persiste una controversia considerable en torno al valor de las pruebas de trombofilia hereditaria, ya que la evidencia sugiere que la presencia de trombofilia no altera el manejo.
Además, las pruebas de trombofilia no identifican todas las causas hereditarias de tromboembolismo venoso. Esto se ilustra con la observación de que solo el 30% de las personas con antecedentes familiares de un pariente de primer grado con TEV tendrán una prueba de detección de trombofilia positiva.
Los pacientes que tienen un TEV diagnosticado en el contexto de un factor de riesgo provocador fuerte, como una cirugía mayor, tienen un riesgo bajo de recurrencia, y este riesgo no se ve alterado significativamente por la presencia de una trombofilia hereditaria. Los pacientes que tienen un TEV que se clasifica como no provocado tienen un riesgo significativamente mayor de recurrencia, pero las pruebas de trombofilia hereditaria no han demostrado alterar este riesgo de una manera que pueda guiar las decisiones sobre la duración de la anticoagulación.
Los familiares identificados como portadores asintomáticos de trombofilia tienen un mayor riesgo de por vida de TEV, pero la mitad de todos los eventos ocurren con factores de riesgo adicionales que los provocan. La presencia de antecedentes familiares positivos sigue siendo significativa, ya que estos pacientes tienen más probabilidades de desarrollar un evento de TEV en comparación con aquellos con una trombofilia hereditaria sin antecedentes familiares.
Por lo tanto, no está claro cómo las pruebas de trombofilia informan el cuidado de los miembros de la familia sin síntomas más allá de la consideración del riesgo impuesto por un historial familiar positivo.
Si se utiliza la prueba de trombofilia, debe realizarse después de completar el tratamiento para un evento de TEV agudo y preferiblemente en ausencia de terapia anticoagulante, ya que los resultados falsos positivos están asociados con warfarina (deficiencia de proteína C, deficiencia de proteína S), heparina (anticoagulante lúpico) y ACOD (anticoagulante lúpico). Los autores sugieren no realizar pruebas de trombofilia hereditaria cuando el TEV está asociado con un factor provocador fuerte, ya que estos pacientes tienen un riesgo bajo de TEV recurrente, incluso cuando se identifica una trombofilia hereditaria.
Tampoco sugieren realizarlas en pacientes con TEV no provocado que ya tienen una indicación de anticoagulación a largo plazo. En los pacientes restantes con TEV no provocado y sin indicación de anticoagulación indefinida, se sugiere discutir con ellos las pruebas de trombofilia hereditaria. En la mayoría de los casos, las pruebas no cambiarán la decisión sobre la duración de la anticoagulación.
En ausencia de evidencia de alta calidad, se debe considerar la preferencia del paciente en tales decisiones. Se debe ofrecer asesoramiento genético a los pacientes sometidos a pruebas, reconociendo los efectos psicológicos que pueden tener esos resultados.
• Síndrome antifosfolípido
El síndrome antifosfolípido es una trombofilia que debe considerarse por separado. Se adquiere, por lo que la mayoría de las personas afectadas no tendrán antecedentes familiares de tromboembolismo venoso.
Se cree que el síndrome antifosfolípido está asociado con un alto riesgo de TEV recurrente y trombosis arterial. La presencia de anticuerpos antifosfolípidos persistentemente elevados con un primer TEV es una indicación aceptable para la duración indefinida de la anticoagulación. El diagnóstico de síndrome antifosfolípido se realiza sobre la base de criterios de laboratorio y clínicos.
Los criterios de laboratorio incluyen la presencia de al menos un anticuerpo asociado en dos o más ocasiones y con al menos 12 semanas de diferencia: anticoagulante lúpico, anti-β2-glicoproteína I (>percentil 99 de los controles), o anticuerpos anti-cardiolipina (> 40 unidades GPL o >percentil 99 de los controles).
Los criterios clínicos incluyen uno o más episodios de trombosis arterial, venosa o de vasos pequeños o una o más morbilidades definidas del embarazo. En los pacientes que presentan un episodio de TEV no provocado, el 6% de los pacientes en general y hasta el 19% de los menores de 50 años cumplirán los criterios para el síndrome antifosfolípido. La identificación del síndrome antifosfolípido puede ser importante para orientar las decisiones sobre la elección del tratamiento anticoagulante.
Dada la alta prevalencia del síndrome antifosfolípido entre los pacientes menores de 50 años con TEV no provocado y las implicaciones para la duración y la elección de la anticoagulación, se debe considerar la detección del síndrome antifosfolípido en estos pacientes.
Se necesitan más estudios para determinar la eficacia de los ACOD en el síndrome antifosfolípido de bajo riesgo. Los autores sugieren el uso de antagonistas de la vitamina K (AVK) sobre otras terapias en la mayoría de los pacientes con síndrome antifosfolípido asociado a anticoagulante lúpico y serología triple positiva.
• Diagnóstico de tromboembolismo pulmonar recurrente
Los pacientes que tienen antecedentes de TVP previa o embolia pulmonar tienen un riesgo mayor de por vida de eventos recurrentes. La anticoagulación reduce la incidencia de TEV recurrente en aproximadamente un 80-85%.
Sin embargo, los pacientes suelen presentar síntomas de TVP recurrente y embolia pulmonar, y diferenciar los síntomas relacionados con las complicaciones crónicas del tromboembolismo venoso, como el síndrome postrombótico y el síndrome post embolismo pulmonar, representa un desafío diagnóstico.
Debido a que el antecedente de TEV previo es una variable en algunas puntuaciones de probabilidad clínica (tabla 1), estos pacientes a menudo se clasifican como de alta probabilidad, lo que requiere imágenes de diagnóstico. Además, la concentración de dímero D permanece elevada en muchos pacientes después de completar un ciclo de tratamiento estándar para el TEV agudo, lo que limita su utilidad para excluir eventos recurrentes.
En un análisis de subgrupos combinado de estudios observacionales, los pacientes con antecedentes de TEV y embolia pulmonar clínicamente sospechada fueron tratados de forma segura utilizando un enfoque de diagnóstico de probabilidad clínica y dímero D. Sin embargo, solo el 16% (en comparación con el 33% de los que no tenían antecedentes de tromboembolismo venoso) pudo excluir la embolia pulmonar sin pruebas de imagen.
Dado que los defectos residuales a menudo persisten en la CTPA y las gammagrafías pulmonares de ventilación-perfusión de 6 a 12 meses después del diagnóstico inicial, la interpretación de las imágenes de diagnóstico para los eventos sospechosos de recurrencia requiere una comparación prudente con las imágenes anteriores para evitar el sobrediagnóstico. La tasa de resolución completa en las imágenes de línea de base varía de aproximadamente el 50% al 84%. Es difícil diferenciar la embolia pulmonar aguda de los trombos residuales y el acuerdo entre los observadores es deficiente.
Se recomienda la disponibilidad y revisión cuidadosa con un radiólogo experimentado de imágenes previas e idealmente imágenes de referencia realizadas de 6 a 12 meses después de un TEP agudo cuando se evalúa a un paciente por TEP recurrente y se ha demostrado que es un enfoque seguro y preciso.
Aunque este puede no ser un enfoque ampliamente adoptado, el riesgo de exposición a la radiación con gammagrafías pulmonares de ventilación-perfusión es bajo y se ha demostrado que la disponibilidad de tales imágenes de referencia mejora la interpretación de las pruebas de diagnóstico para la sospecha de TEV recurrente.
Tratamiento inicial del TEP
• Evaluación del riesgo de TEP
La embolia pulmonar sigue siendo una condición heterogénea, que va desde la presentación con muerte súbita hasta hallazgos incidentales sin síntomas. La inestabilidad hemodinámica inicial, definida como presión arterial sistólica por debajo de 90 mm Hg durante 15 minutos o más, es un marcador importante de pronóstico.
Sin embargo, esta presentación es infrecuente, encontrándose solo en el 5% de los casos; la mortalidad a corto plazo supera el 15%. Para el 95% restante de los casos, se han propuesto varias puntuaciones de predicción del riesgo para estimar el riesgo de un resultado adverso (tabla 2).
 Tabla 2. Comparación de las puntuaciones de predicción del riesgo de TEP
Tabla 2. Comparación de las puntuaciones de predicción del riesgo de TEPAmbas puntuaciones de predicción de riesgo pudieron diferenciar entre un riesgo bajo y alto de mortalidad a 30 días en pacientes con TEP. También se han estudiado biomarcadores. Una revisión sistemática mostró que en pacientes clasificados como de bajo riesgo por la puntuación PESI o sPESI, la presencia de una troponina positiva tenía una probabilidad combinada cinco veces mayor de mortalidad a los 30 días, aunque el amplio intervalo de confianza arroja dudas sobre la fiabilidad de esta estimación.
Se han propuesto otros marcadores de pronóstico para la estratificación del riesgo, incluido el péptido natriurético de tipo B y el péptido natriurético de tipo N-terminal pro-b (NT-proBNP). La evidencia de disfunción ventricular derecha por ecocardiografía y CTPA también son indicadores de peor pronóstico.
Aunque la opinión sobre su utilidad es divergente, las imágenes del ventrículo derecho y los biomarcadores cardíacos pueden considerarse para seleccionar a los pacientes que necesitan monitorización cardíaca, si no se dispone de un seguimiento estrecho.
• Tratamiento ambulatorio versus hospitalario del TEP agudo
La estratificación del riesgo se ha utilizado para identificar a los pacientes con un bajo riesgo de mortalidad a corto plazo para seleccionarlos para el tratamiento ambulatorio. La disponibilidad de ACOD ha simplificado el tratamiento ambulatorio de la embolia pulmonar porque algunos ACOD no requieren la autoadministración inicial de terapias parenterales.
Los ECA han comparado el manejo ambulatorio versus hospitalario de la embolia pulmonar y no encontraron diferencias en los resultados en pacientes seleccionados. No se observaron diferencias significativas en el resultado primario de la incidencia de TEV recurrente a los tres meses en pacientes ambulatorios versus pacientes hospitalizados. Los criterios de Hestia (tabla 2) se han combinado con troponina cardíaca y NT-proBNP, sin que se observe ningún beneficio adicional de ninguno de los marcadores en comparación con los criterios de Hestia solos.
Un ECA de 114 pacientes con embolia pulmonar de bajo riesgo, sin criterios de Hestia y una troponina negativa informó una reducción en el resultado primario de tiempo pasado en el hospital por TEV o eventos hemorrágicos 30 días después de la aleatorización.
Basados en esta y otras evidencias, los autores apoyan las recomendaciones para el manejo ambulatorio del tromboembolismo pulmonar; la identificación y el tratamiento ambulatorio de las embolias pulmonares adecuadas representarán un ahorro de costos significativo sin comprometer la seguridad del paciente.
• Tromboembolismo pulmonar subsegmentario
El mayor uso y sensibilidad de CTPA ha visto un aumento de émbolos pulmonares únicos o múltiples aislados en las arterias pulmonares subsegmentarias más pequeñas. A pesar de este aumento, la mortalidad general relacionada con la embolia pulmonar no ha cambiado, y esto puede explicar la disminución de la letalidad. La importancia clínica de la embolia pulmonar subsegmentaria sigue siendo incierta, y las recomendaciones se extrapolan principalmente de ensayos históricos de gammagrafía pulmonar de ventilación-perfusión.
En el estudio PIOPED, el 17% de los pacientes tenían defectos aislados en las arterias pulmonares subsegmentarias, lo que corresponde a una gammagrafía pulmonar de ventilación-perfusión de “baja probabilidad”. En estudios observacionales, estos pacientes de baja probabilidad no fueron tratados si se realizaron una ecografía de compresión bilateral de miembros inferiores y una ecografía de compresión en serie. Se demostró que esta es una estrategia segura y sigue siendo el tratamiento actual de estos pacientes.
El diagnóstico de TEP subsegmentario se complica por la escasa concordancia entre los observadores y el reconocimiento de que muchas embolias pulmonares subsegmentarias son interpretadas como falsos positivos por radiólogos experimentados. Esto ha llevado a la recomendación de que el TEP subsegmentario en ausencia de TVP puede no necesitar ser tratado con anticoagulación.
Los autores sugieren por ende que el TEP subsegmentario aislado en CTPA, en ausencia de cáncer o características de alto riesgo como una reserva cardiopulmonar pobre, puede abordarse como lo haría con una gammagrafía pulmonar de ventilación-perfusión no diagnóstica: con ecografía de compresión bilateral de miembro inferior basal y seriada y ningún tratamiento anticoagulante a menos que se detecte TVP.
• Elección de la anticoagulación para el TEP agudo
La terapia de anticoagulación para el TEP agudo confirmada es el pilar del tratamiento y se puede dividir en tres fases: fase inicial de cero a siete días, terapia a largo plazo de una semana a tres meses y terapia prolongada de tres meses en adelante/indeterminada. El recuadro 2 muestra las opciones de anticoagulación y la dosificación durante cada fase.
La anticoagulación parenteral con heparina de bajo peso molecular (HBPM), fondaparinux o heparina intravenosa no fraccionada se usa típicamente en pacientes ingresados ??en el hospital para el tratamiento inicial de la embolia pulmonar. Los pacientes estables al alta del hospital o aquellos pacientes aptos para tratamiento ambulatorio desde el momento del diagnóstico de embolia pulmonar aguda pueden ser tratados con ACOD.
Los ACOD se administran en dosis fijas y no requieren un control de laboratorio de rutina (tabla 3). Cada ACOD se ha considerado no inferior a la combinación AVK / HBPM en ECA de fase III para la prevención de El TEV recurrente sintomática en pacientes con tromboembolia venosa aguda). Los ACOD también tienen significativamente menos episodios hemorrágicos importantes en comparación con los AVK (tabla 4).
Las limitaciones de estos ensayos incluyen poblaciones heterogéneas y la falta de comparaciones directas entre los ACOD. Está en curso un ECA que compara rivaroxabán y apixabán para pacientes con TEV agudo, que evalúa las diferencias en el sangrado clínicamente relevante con estos anticoagulantes.
| Recuadro 2. Fases del tratamiento del tromboembolismo pulmonar Inicial (0-7 días) Apixaban 10 mg BID durante 7 días Rivaroxabán 15 mg BID durante 21 días HBPM / fondaparinux durante un mínimo de 5 días * y RIN ≥2 durante 2 días Largo plazo (1 semana a 3 meses) Apixaban 5 mg BID Dabigatrán 150 mg BID Edoxabán 60 mg al día † Rivaroxabán 20 mg al día Warfarina por INR 2-3 Extendido (3 meses en adelante) Apixaban 5 mg BID o 2,5 mg BID ‡ Ácido acetilsalicílico 81-100 mg al día, si no es posible la anticoagulación Dabigatrán 150 mg BID Edoxabán 60 mg al día † Rivaroxabán 20 mg al día o 10 mg al día ‡ Warfarina por INR 2-3 BID=dos veces al día; RIN=razón internacional normalizada; HBPM=heparina de bajo peso molecular * Se necesita HBPM durante 5 a 10 días antes de comenzar con dabigatrán o edoxabán † 30 mg al día si el aclaramiento de creatinina es 30-50 ml / min o un peso <60 k ‡ Se puede considerar la reducción de la dosis después de 6 meses de terapia. |
• Tratamiento del TEP asociado al cáncer
Los pacientes con cáncer tienen un riesgo siete veces mayor de TEV, con un riesgo absoluto general del 7% durante el primer año de un diagnóstico de cáncer y hasta un 20% según el tipo de cáncer y los tratamientos utilizados. La embolia pulmonar puede ser sintomática o encontrarse incidentalmente en las imágenes para evaluar la respuesta al tratamiento del cáncer. Las embolias pulmonares sintomáticas o incidentales tienen un riesgo similar de recurrencia.
Las complicaciones hemorrágicas graves también son más comunes con el TEV en pacientes con cáncer. El tratamiento de la embolia pulmonar aguda sintomática e incidental se individualiza de acuerdo con el riesgo de embolia pulmonar recurrente y hemorragia. El uso prolongado de HBPM dominó el campo del TEV asociado al cáncer durante mucho tiempo.
Desde entonces, cuatro ECA han comparado ACOD y HBPM en pacientes con TEV asociado al cáncer. El ECA HOKUSAI VTE Cancer mostró que edoxabán (después de cinco días con HBPM) no era inferior a la HBPM para el resultado primario de TEV recurrente o hemorragia mayor durante los 12 meses siguientes. Se observó una tasa de TEV más baja no significativa, pero la tasa de hemorragia mayor fue significativamente mayor en pacientes tratados con edoxabán. Los episodios hemorrágicos graves se observaron principalmente en el subgrupo de pacientes con neoplasias malignas del tracto gastrointestinal superior.
Un segundo ECA, SELECT-D, comparó rivaroxabán y HBPM para el tratamiento agudo del TEV asociado al cáncer. La tasa acumulada de recurrencia de TEV a los seis meses fue del 11% (7% a 16%) para dalteparina y del 4% (2% a 9%) para rivaroxaban, con menos TEV recurrentes en pacientes tratados con rivaroxabán. Desafortunadamente, el reclutamiento lento en el ensayo piloto SELECT-D resultó en una incapacidad para comparar definitivamente la eficacia y seguridad de rivaroxaban y HBPM.
Dos ECA compararon apixaban y HBPM para el tratamiento del TEV asociado al cáncer. El ensayo ADAM VTE comparó apixabán y HBPM durante seis meses de tratamiento. La trombosis recurrente fue más común en el grupo de HBPM. No se observaron diferencias en los resultados de seguridad de hemorragia mayor o tasas de hemorragia no mayor clínicamente relevantes al 6% en cada grupo.
El ensayo CARAVAGGIO asignó al azar a 1.170 pacientes a apixabán o HBPM durante seis meses de tratamiento. El apixabán no fue inferior a la HBPM para el resultado primario de TEV recurrente durante el período de prueba de seis meses. No se observaron diferencias en la hemorragia mayor, el principal resultado de seguridad.
El consenso de expertos clínicos canadienses proporciona un algoritmo de tratamiento para pacientes con cáncer y TEV agudo, considerando el riesgo de hemorragia, las preferencias informadas del paciente y el reembolso de los medicamentos (fig. 3). Esta declaración de consenso se realizó antes de la publicación de los ensayos ADAM VTE y CARAVAGGIO, cuyos resultados también apoyarían al apixabán para el tratamiento del TEV asociado al cáncer.
En general, los pacientes con embolia pulmonar asociada a cáncer sin contraindicación para la anticoagulación se evalúan para el riesgo de hemorragia sobre la base de antecedentes de hemorragia, comorbilidades y tipo de malignidad. Las interacciones fármaco-fármaco son otra consideración, especialmente para los ACOD. Todos los ACOD son sustratos de la glicoproteína P; apixaban y rivaroxaban también son sustratos del citocromo P450 (CYP3A4), mientras que edoxabán y dabigatrán no lo son.
La determinación de interacciones medicamentosas clínicamente relevantes es compleja en pacientes con cáncer, ya que a menudo se tratan con muchas terapias contra el cáncer que pueden competir por una vía metabólica común. La elección del anticoagulante debe hacerse de forma individual y en consulta con un farmacéutico para evaluar las interacciones fármaco-fármaco.
| Recuadro 3. Fases del tratamiento de la embolia pulmonar asociada al cáncer Inicial (0-7 días) HBPM / fondaparinux por un mínimo de 5 días * Apixaban 10 mg BID durante 7 días † Rivaroxabán 15 mg BID durante 21 días Largo plazo (1 semana a 6 meses) HBPM Apixaban 5 mg VO BID † Edoxabán 60 mg al día ‡ Rivaroxabán 20 mg al día VKA por RIN 2-3 Extendido (6 meses a indefinido) HBPM Apixaban 5 mg VO BID † Edoxabán 60 mg al día ‡ Rivaroxabán 20 mg al día AVK por RIN 2-3 BID=dos veces al día; RIN=razón internacional normalizada; HBPM=heparina de bajo peso molecular; AVK=antagonista de la vitamina K * Se necesita HBPM durante 5 a 10 días antes de comenzar con edoxabán † No incluido en las recomendaciones originales de consenso de expertos canadienses ‡ 30 mg al día si el aclaramiento de creatinina es de 30 a 50 ml / min o si el peso es <60 kg |
Los ACOD y el fondaparinux atraviesan la placenta y deben evitarse durante el embarazo. La heparina no fraccionada y la HBPM son más seguras durante el embarazo ya que no atraviesan la placenta; la HBPM es el pilar del tratamiento debido a su dosificación una vez al día y la autoadministración por vía subcutánea.
El manejo de la anticoagulación en el momento del parto requiere una estrecha coordinación con un equipo multidisciplinario de obstetricia, anestesia, hematología y medicina materno-fetal. Un ECA reciente de 3.062 embarazos de bajo riesgo mostró que la inducción programada del trabajo de parto es segura, no aumenta el riesgo de parto por cesárea y tuvo un pequeño beneficio en el resultado primario de muerte perinatal o complicaciones neonatales graves.
En pacientes con un evento de TEV agudo en el embarazo actual que ocurrió más de un mes antes de la fecha de parto prevista, los autores sugieren una inducción programada del trabajo de parto con la última dosis de HBPM administrada 24 horas antes. La interrupción de la HBPM 24 horas antes del parto permite el uso seguro de anestesia neuroaxial si es necesario.
En ausencia de hemorragia posparto, la HBPM se reinicia seis horas después del parto y se continúa durante al menos seis semanas posparto. En pacientes que tienen una embolia pulmonar aguda dentro de un mes del parto esperado, también sugerimos la inducción programada del trabajo de parto pero la administración de heparina no fraccionada en dosis terapéuticas hasta el trabajo de parto activo para evitar interrupciones prolongadas del tratamiento.
Si la embolia pulmonar se produjo en menos de dos semanas desde el momento del parto, se puede considerar un filtro de vena cava inferior (VCI). Las opciones de tratamiento anticoagulante posparto para las mujeres que están amamantando incluyen heparina no fraccionada, HBPM , AVK, fondaparinux o danaparoid.
Los ACOD se concentran en la leche materna y están contraindicados, pero pueden considerarse en mujeres que no están amamantando o después de completar la lactancia en aquellas que tienen una indicación de tratamiento a más largo plazo. Se recomienda la profilaxis de TEV preparto y posparto con HBPM para embarazos futuros.
• Trombólisis para el TEP agudo
La terapia trombolítica, ya sea sistémica (más común) o dirigida por un catéter en las arterias pulmonares, puede usarse para acelerar la resolución de la embolia pulmonar aguda, disminuir la presión de la arteria pulmonar y aumentar la oxigenación arterial. El 5% de los pacientes presentará compromiso hemodinámico con presión arterial sistólica persistentemente menor de 90 mm Hg, siendo el subgrupo con mayor riesgo de mortalidad temprana, por lo que son los que más se benefician de la terapia trombolítica.
El sangrado es la limitación principal las tasas de sangrado mayor son del 10% o más). Una presión arterial sistólica persistentemente menor de 90 mm Hg durante al menos 15 minutos y sin alto riesgo de hemorragia se considera una indicación para el tratamiento inmediato con terapia trombolítica sistémica (evidencia de mala calidad).
La trombólisis dirigida por catéter (TDC) es un método alternativo para la administración de trombólisis con un riesgo potencialmente menor de hemorragia (un tercio de la dosis de fármaco trombolítico en comparación con la administración sistémica). En un ECA de 59 pacientes con embolia pulmonar aguda sin evidencia de compromiso hemodinámico en la presentación, la TDC mostró un beneficio en el resultado primario de mejoría de la función ventricular derecha a las 24 horas.
Las tasas de hemorragia mayor varían entre los estudios, pero algunos informan que son similares a las de la trombólisis sistémica. El papel de la CTD sigue sin estar claro, y los autores no recomiendan su uso rutinario excepto en centros experimentados cuando un paciente tiene compromiso hemodinámico y un alto riesgo de hemorragia y la terapia puede iniciarse sin demora.
Un metanálisis en red de todos los ECA que compararon los procedimientos de recanalización para la embolia pulmonar aguda no encontró ningún beneficio significativo en la mortalidad general para ningún método de trombólisis y un riesgo significativamente mayor de hemorragia, especialmente con trombólisis sistémica de dosis completa.
Para los pacientes que presentan inestabilidad hemodinámica persistente durante al menos 15 minutos, en ausencia de evidencia de alta calidad, pero también considerando la alta mortalidad a corto plazo de este grupo, los autores sugieren el uso de trombólisis sistémica en pacientes sin contraindicación absoluta.
Para los pacientes con inestabilidad hemodinámica persistente pero con alto riesgo o con contraindicaciones para la trombólisis sistémica, los autores sugieren que la trombólisis dirigida por catéter se puede considerar para cada caso individual, cuando esté disponible. Para todos los demás pacientes considerados de alto riesgo de deterioro a corto plazo, se sugiere observación en un entorno monitoreado, con terapia trombolítica reservada para el deterioro hemodinámico.
• Embolectomía quirúrgica
La embolectomía quirúrgica con derivación cardiopulmonar se puede realizar en pacientes con embolia pulmonar aguda asociada con inestabilidad hemodinámica y contraindicación para la terapia trombolítica. Las series de casos publicadas han mostrado resultados variables, con una mortalidad perioperatoria que oscila entre el 4 y el 59%.
La edad avanzada, el paro cardíaco prequirúrgico y la terapia trombolítica prequirúrgica se asocian con peores resultados. La oxigenación por membrana extracorpórea (ECMO), ya sea sola o como puente a la embolectomía quirúrgica, también ha mostrado beneficios en informes de casos y series de casos pequeñas.
La ECMO requiere anticoagulación continua y puede inducir una coagulopatía de consumo, lo que genera un alto riesgo de hemorragia. En un paciente con inestabilidad hemodinámica significativa y contraindicación para la trombólisis, se puede considerar la embolectomía quirúrgica y/o ECMO.
• Filtros de vena cava
Los filtros IVC se introdujeron por primera vez en 1973 y se diseñaron para atrapar mecánicamente los émbolos venosos de las extremidades inferiores para prevenir el TEP. Desde entonces, el uso de filtros de VCI ha aumentado drásticamente, a pesar de la falta de evidencia de un efecto sobre la mortalidad relacionada con el TEV.
Las guías de las principales sociedades clínicas difieren en la indicación sugerida para los filtros de VCI, pero en general coinciden en su uso en pacientes con trombosis venosa profunda proximal aguda o embolia pulmonar y una contraindicación para la anticoagulación. El uso de filtros de VCI para otras indicaciones se ha expandido mucho en los últimos años, pero no está impulsado por evidencia.
La colocación preventiva de un filtro VCI permanente además de la anticoagulación estándar en pacientes de alto riesgo con TVP proximal aguda se investigó en el estudio PREPIC, un ECA de 400 pacientes, que mostró una reducción en el resultado primario de embolia pulmonar temprana diagnosticada dentro de los primeros 12 días pero ninguna diferencia en la mortalidad.
Los datos de seguimiento a más largo plazo mostraron resultados similares, con una reducción de la embolia pulmonar en el brazo del filtro de VCI, pero un aumento significativo en la TVP recurrente y sin diferencias en la mortalidad general.
Un ECA de seguimiento, PREPIC-2, estudió los filtros de VCI extraíbles en 399 pacientes con embolia pulmonar de alto riesgo y no mostró ningún beneficio en el uso del filtro combinado con anticoagulación estándar en comparación con la anticoagulación sola en el resultado primario de embolia pulmonar recurrente en tres meses.
Los autores sugieren que los filtros VCI deben restringirse a pacientes con TVP proximal aguda o embolia pulmonar en quienes no se puede administrar la anticoagulación de dosis completa debido a una hemorragia activa incontrolable o un alto riesgo de hemorragia potencialmente mortal (por ejemplo, defecto de coagulación, trombocitopenia grave, hemorragia cerebral reciente o lesión cerebral con alto riesgo de sangrado) o cirugía urgente que requiera la interrupción de la anticoagulación.
En tales pacientes, se debe evaluar con frecuencia la seguridad de iniciar o reanudar la anticoagulación. Una vez que se puede reiniciar la anticoagulación con la dosis completa sin recurrencia del sangrado mayor, el filtro de la VCI debe retirarse de inmediato para reducir la posibilidad de complicaciones relacionadas con el filtro de la VCI, que aumentan con el tiempo.
Duración del tratamiento del TEP
La duración del tratamiento depende de la presencia o ausencia de factores de riesgo en el momento del diagnóstico (ver recuadro 1). El Subcomité Científico de la ISTH sugiere evaluar el riesgo de TEV recurrente de los pacientes.
En pacientes con menos del 5% de riesgo al año o menos del 15% a los cinco años, la recomendación es suspender la anticoagulación. En el TEP provocado por factores de riesgo transitorios importantes como la cirugía mayor, el riesgo de embolia pulmonar recurrente al año es inferior al 1%, lo que favorece la interrupción de la anticoagulación a los tres meses.
En aquellos con factores de riesgo transitorios menores, como embolia pulmonar asociada a hormonas, el riesgo de TEV recurrente es aproximadamente del 15% a los cinco años y es importante considerar los riesgos de hemorragia mayor relacionada con la anticoagulación al recomendar un tratamiento prolongado en este grupo intermedio.
En pacientes sin factor de riesgo identificable (embolia pulmonar no provocada), una revisión sistemática reciente y un metanálisis de 18 estudios (ECA y estudios observacionales) evaluó el riesgo de TEV recurrente en pacientes con un primer TEV no provocado.
Los resultados sugieren que los pacientes con un primer TEV no provocado tienen un riesgo sustancial de trombosis recurrente, y esto debería orientar las decisiones sobre la terapia anticoagulante prolongada. La anticoagulación de duración intermedia, como extender el período de tratamiento inicial a uno o dos años antes de suspender la terapia, no reduce el riesgo subsiguiente de TEV recurrente después de suspender la anticoagulación.
La estratificación del riesgo para pacientes con TEV no provocado también puede ayudar a determinar el riesgo de trombosis recurrente. Marcadores de pronóstico de TEV recurrente incluyen el sexo masculino, la edad avanzada, trombofilia hereditaria, obesidad, dímero D persistentemente positivo, y obstrucción pulmonar residual en la gammagrafía pulmonar de ventilación-perfusión. Individualmente, estos factores de riesgo son insuficientes para recomendar la anticoagulación a largo plazo; sin embargo, se han propuesto modelos de predicción de riesgos que incorporan varias combinaciones.
La regla de decisión clínica más grande validada de forma prospectiva (2.785 pacientes) es "Los hombres continúan y HERDOO-2". En la cohorte de derivación de esta regla de predicción, los hombres tenían un riesgo anual de TEV recurrente del 13,9% mientras estaban sin anticoagulación, por lo que permanecieron con anticoagulación en la cohorte de validación.
Las mujeres, por otro lado, se estratificaron en grupos de riesgo, de modo que la anticoagulación podría suspenderse en mujeres con 0 o 1 puntos HERDOO (hiperpigmentación, edema o enrojecimiento de cualquiera de los miembros inferiores, dímero D> 250 μg / L, obesidad (masa corporal índice >30), mayor edad (≥65 años)).
El riesgo anual de TEV recurrente en mujeres de bajo riesgo fue del 1,6% en la cohorte de derivación y del 3% en la cohorte de validación. Las mujeres con 2 o más puntos HERDOO se consideraron de alto riesgo y tuvieron una tasa anual de TEV recurrente del 14,1% en la cohorte de derivación y permanecieron con anticoagulación en el estudio de validación. Las opciones de anticoagulantes para el tratamiento prolongado del TEV se muestran en el recuadro 2. La anticoagulación oral reduce el riesgo de TEV recurrente solo durante el tratamiento.
La identificación de pacientes con TEV índice no provocado que se beneficiarían de la anticoagulación prolongada para el tratamiento prolongado y la prevención secundaria debe equilibrarse con el riesgo de hemorragia durante la anticoagulación.
Los factores de riesgo de hemorragia incluyen edad mayor de 75 años, antecedentes de hemorragia, enfermedad hepática crónica, enfermedad renal crónica, accidente cerebrovascular previo y el uso concomitante de agentes antiplaquetarios o antiinflamatorios no esteroides. Como los riesgos de sangrado y tasas de letalidad asociados son más bajos para los ACOD que los AVK, cuando sea posible, los ACOD deben ser considerados sobre los AVK.
El recuadro 2 muestra las opciones de dosificación de ACOD para el tratamiento prolongado, incluida la continuación de la misma dosis que para el tratamiento a largo plazo o la dosis reducida de rivaroxaban y apixaban. El ECA EINSTEIN CHOICE comparó rivaroxabán 20 mg al día y rivaroxabán 10 mg al día con 100 mg de aspirina al día para el tratamiento prolongado de TEV en 3.400 participantes que completaron al menos seis a 12 meses de anticoagulación para El TEV aguda.
Para el resultado primario de eficacia de TEV recurrente / fatal, rivaroxabán se asoció con menos eventos en comparación con la aspirina. El resultado de seguridad primario de hemorragia mayor no fue diferente para ninguna de las dosis de rivaroxabán en comparación con aspirina. Las limitaciones de EINSTEIN CHOICE se centran en la población con TEV predominantemente provocado (60% de los participantes). Se desconoce si rivaroxabán 10 mg al día es tan eficaz como 20 mg al día en pacientes no seleccionados de alto riesgo con TEV no provocado.
El estudio AMPLIFY EXT RCT comparó dos dosis de apixabán, 5 mg dos veces al día y 2,5 mg dos veces al día, con placebo durante 12 meses para la prevención del TEV recurrente / mortalidad por todas las causas. El apixabán en ambas dosis resultó en menos eventos de resultado primario recurrentes en comparación con placebo.
La hemorragia mayor fue el resultado principal de seguridad y se produjo con una frecuencia similar en cada grupo de apixabán. Más del 90% de los participantes en AMPLIFY EXT tenían TEV índice no provocado, lo que les asegura que ambas dosis de apixaban reducen el riesgo de TEV recurrente en esta población de pacientes de alto riesgo. sin aumentar los episodios hemorrágicos.
Estudios en curso como RENOVE están evaluando la terapia prolongada de ACOD de dosis completa en comparación con ACOD de dosis reducida para pacientes con TEV índice no provocado. Mientras tanto, deben incorporarse las preferencias de los pacientes y la evaluación regular de los riesgos de hemorragia en las decisiones sobre la terapia prolongada. Los autores recomiendan una reevaluación anual de los riesgos de hemorragia y TEV recurrente para informar las decisiones sobre la anticoagulación prolongada.
En el TEP asociado al cáncer, el cáncer es un factor de riesgo persistente importante y se sugiere la necesidad de una terapia de anticoagulación prolongada, más allá de los seis meses, para los pacientes con cáncer activo (enfermedad metastásica) o que reciben quimioterapia.
Consecuencias a largo plazo del TEP
• Síndrome post-TEP
Hasta el 50% de los pacientes informan secuelas a largo plazo después de una embolia pulmonar. El síndrome post-TEP ha sido definido por la función subóptima cardiaca, la dinámica de flujo de la arteria pulmonar, o el intercambio de gases pulmonar en reposo o durante el ejercicio, en combinación con disnea, disminución de la tolerancia al ejercicio, o disminución del estado funcional o la calidad de vida, sin una explicación alternativa.
En el extremo, la hipertensión pulmonar tromboembólica crónica (HPTEC) ocurre en aproximadamente el 3% de los pacientes que sobreviven después de un período de tratamiento de seis meses por embolia pulmonar aguda. Se desconoce la fisiopatología exacta de por qué ocurre la HPTEC en una minoría de pacientes.
Los factores de riesgo para el desarrollo de HPTEC después de una embolia pulmonar aguda incluyen retraso en el diagnóstico, alta carga de trombos, TEP sintomático recurrente, hipertensión pulmonar o disfunción del ventrículo derecho al inicio del estudio y no lograr la resolución del trombo. El diagnóstico de HPTEC se confirma al mostrar una presión arterial pulmonar media superior a 25 mm Hg combinada con obstrucciones vasculares pulmonares trombóticas.
La exploración pulmonar de ventilación-perfusión plana es la modalidad de imagen preferida, con una alta sensibilidad y especificidad para la HPTEC. La endarterectomía pulmonar bilateral a través de la capa medial de las arterias pulmonares es un tratamiento curativo para la HPTEC, pero la mayoría de los pacientes necesitan anticoagulación de por vida debido al riesgo de TEV recurrente.
Un segundo subconjunto de pacientes son aquellos con evidencia de enfermedad tromboembólica crónica sin hipertensión pulmonar. Las pruebas funcionales cardiopulmonares sugieren que este es un fenotipo clínico intermedio en respuesta al ejercicio. Un estudio observacional (ELOPE) siguió a 100 pacientes con TEP agudo y realizó una prueba de esfuerzo cardiopulmonar al mes ya los 12 meses.
De acuerdo con los síntomas autoinformados al año, casi el 50% de estos pacientes tenían evidencia de disminución de la capacidad de ejercicio. La reducción de la capacidad de ejercicio cardiopulmonar observada se correlacionó bien con varias mediciones de la calidad de vida y la prueba de caminata de seis minutos.
La obstrucción pulmonar residual inicial no se asoció con la limitación del ejercicio, ni tampoco las pruebas de función pulmonar o los resultados ecocardiográficos. Los predictores de las limitaciones del ejercicio fueron la edad, el índice de masa corporal y los antecedentes de tabaquismo.
La ausencia de asociación con la carga de coágulos residuales basales y la capacidad de ejercicio cardiopulmonar también es consistente con el estudio de seguimiento a largo plazo de pacientes con embolia pulmonar que tuvieron trombólisis sistémica, ya que no se observó ningún beneficio en la disnea o la capacidad de ejercicio informadas.
El síndrome post-embolia pulmonar describe una consolidación heterogénea de síntomas y hallazgos objetivos que tiene un efecto importante en la calidad de vida de los pacientes con embolia pulmonar. Se recomienda el seguimiento de los pacientes más allá del período de embolia pulmonar aguda y la detección de disnea persistente y limitaciones funcionales a los tres a seis meses. Se evaluan a todos los pacientes que informan disnea persistente con una gammagrafía pulmonar de ventilación-perfusión para evaluar defectos persistentes no coincidentes y ecocardiograma transtorácico para hipertensión pulmonar. Se puede ofrecer rehabilitación cardiopulmonar dirigida y modificaciones en el estilo de vida a los pacientes restantes, aunque se necesitan investigaciones futuras para determinar los beneficios de dichos programas.
• Impacto psicológico y calidad de vida
El diagnóstico de una embolia pulmonar tiene un efecto psicológico significativo en los pacientes, que a menudo se refieren a tal evento como una experiencia cercana a la muerte. El estudio ELOPE descrito anteriormente siguió a una cohorte de pacientes con embolia pulmonar aguda durante un año y mostró una disminución aguda en las puntuaciones de calidad de vida, pero estas puntuaciones luego mejoraron durante el seguimiento de un año. Las entrevistas cualitativas a pacientes de 6 a 12 meses después de un diagnóstico de TEV informaron un “cambio de vida y cambio para siempre” al describir su experiencia vivida con tromboembolismo venoso. Algunos pacientes también notaron un "pánico postrombótico", que describe sentimientos de hipervigilancia y pánico relacionados con el miedo a la recurrencia de la enfermedad. Es evidente que existe la necesidad de un mayor reconocimiento del bienestar psicológico de los pacientes y de la investigación de posibles apoyos específicos.
Directrices
En siguiente tabla se resumen las guías que parecen ser las más relevantes, actualizadas y avaladas por las principales sociedades internacionales en lo que respecta al manejo de pacientes con embolia pulmonar.

Tratamientos emergentes
Las terapias anticoagulantes dirigidas a los factores de coagulación IX, XI y XII se encuentran en investigación y desarrollo. De estos, la inhibición del factor XIa es la más desarrollada. Büller et al asignaron al azar a 300 pacientes a 200 mg o 300 mg de FXI-ASO, administrados como una serie de inyecciones subcutáneas durante 36 días antes de la operación, o profilaxis con enoxaparina.
El régimen de 200 mg no fue inferior y el régimen de 300 mg fue superior a la enoxaparina (P <0,001). Weitz et al asignaron al azar a 813 pacientes después de una artroplastia de rodilla electiva a enoxaparina, apixaban o infusiones intravenosas únicas del inhibidor del factor XIa osocimab en varias dosis y horarios (preoperatorio / postoperatorio).
Las dosis de osocimab de 0,6 mg/kg, 1,2 mg/kg y 1,8 mg/kg administradas postoperatoriamente cumplieron los criterios de no inferioridad en comparación con enoxaparina para el resultado primario de nuevo TEV (sintomático o asintomático), y la dosis preoperatoria de 1,8 mg/kg de osocimab cumplió los criterios de superioridad en comparación con la enoxaparina. Se necesitan más estudios para determinar la verdadera eficacia y el riesgo de hemorragia de estos nuevos anticoagulantes.
Conclusión
|
































No hay comentarios:
Publicar un comentario