

Se aprobó el avapritinib para tratar tumores del estroma gastrointestinal con una alteración genética poco común
, por el Equipo del NCI
Las personas con tumores del estroma gastrointestinal (TEGI), que se caracterizan por una alteración genética específica, tienen una nueva opción de terapia dirigida.
El 9 de enero, la Administración de Alimentos y Medicamentos (FDA) aprobó el uso del avapritinib (Ayvakit) en algunos adultos con TEGI, cuyos tumores presentan una alteración en una parte del gen PDGFRA llamada exón 18. La más común de estas alteraciones es la mutación D842V. La aprobación es solo para pacientes con tumores que no se pueden extirpar con cirugía o que se diseminaron a otros lugares del cuerpo.
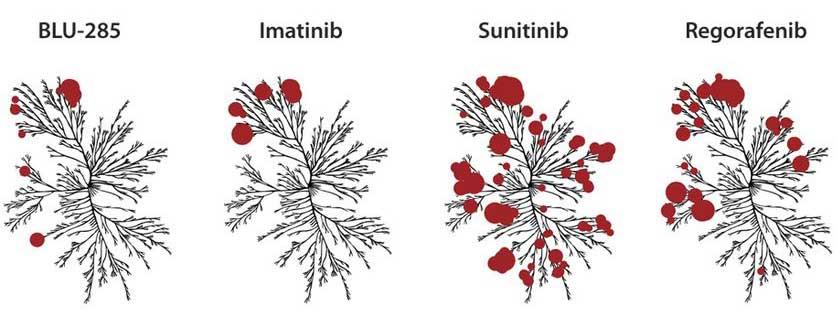
Aunque en la mayoría de las personas con TEGI el tratamiento con un medicamento dirigido que se llama imatinib (Gleevec) es eficaz por un tiempo, estos tumores suelen volverse resistentes a los pocos años. Sin embargo, es posible que las personas con TEGI cuya enfermedad progresó durante el tratamiento con imatinib se beneficien igual con el uso de medicamentos similares, incluso el sunitinib (Sutent).
No obstante, ninguno de estos medicamentos aprobados con anterioridad para tratar los TEGI son eficaces si hay mutaciones en el exón 18 de PDGFRA. Por el contrario, en el estudio clínico pequeño que condujo a la aprobación del avapritinib, 84 % de los participantes que tenían tumores con esta mutación se achicaron o desaparecieron por completo y en 12 % de los participantes, los tumores dejaron de crecer.
Además, estas respuestas tumorales fueron de larga duración. De hecho, 1 año después de comenzar el tratamiento, 74 % de los tumores que respondieron al avapritinib aún no habían vuelto a crecer (progresar), y 90 % de los pacientes estaban vivos 1 año después de ingresar en el estudio.
Para los pacientes que tienen tumores con mutaciones en el exón 18 de PDGFRA, "esta aprobación cambia el panorama por completo… pasan de 'no tener ninguna esperanza de que algo funcione' a tener algo que tal vez funcione para casi todos", dijo el doctor Michael Heinrich, de la Universidad de Salud y Ciencia de Oregón (OHSU), un investigador del estudio.
La aprobación destaca también una tendencia general en la investigación del cáncer a diseñar medicamentos para grupos pequeños de pacientes que se definen por sus características genéticas, señaló el doctor John Glod, del Centro de Investigación Oncológica del NCI, quien no participó en el estudio.
"Pienso que la oncología es así en la actualidad", recalcó el doctor Glod, especialista en el tratamiento de sarcomas, incluso los TEGI. "Estamos separando enfermedades por grupos de pacientes cada vez menos numerosos, y los medicamentos nuevos a veces funcionan muy bien para esos pacientes".
Un candado sin llave
En las personas con TEGI, es común que los tumores se descubran en el estómago y el intestino delgado, pero aparecen en cualquier lugar del tubo gastrointestinal o cerca de este. En algunas personas, los TEGI se tratan mediante cirugía sola. Pero cuando no es posible extirpar un tumor por completo con cirugía o cuando este se diseminó a otras partes del cuerpo (metástasis), el tratamiento estándar son las terapias dirigidas. El 85 % de los TEGI presentan mutaciones en uno de dos genes: PDGFRA o KIT. Estas mutaciones conducen a la producción de proteínas KIT y PDGFRA anormales que promueven el cáncer, explicó el doctor Heinrich. Por lo general, es posible frenar estas dos proteínas con el imatinib y otros medicamentos similares, llamados inhibidores de la tirosina cinasa, que bloquean la actividad de la proteína.
"La proteína [mutada] actúa como el motor del cáncer. Cuando logramos desactivar estas proteínas, apagamos el motor, y las células cancerosas mueren o dejan de multiplicarse", manifestó el doctor Heinrich.
Otros inhibidores de la tirosina cinasa que se usan para tratar los TEGI se unen con firmeza a partes de las proteínas KIT o PDGFRA, que normalmente controlan cuánta energía absorben las células. No obstante, la mutación en el exón 18 de PDGFRA cambia la proteínas PDGFRA de tal forma que impide la unión de los medicamentos, agregó el doctor Heinrich.
"La mutación [en el exón 18] de PDGFR [crea] un candado que ninguna de nuestras llaves existentes puede abrir", explicó el doctor.
Por este motivo en particular, se eligió formular el avapritinib por su capacidad para unirse a las proteínas PDGFRA y KIT. En estudios de laboratorio, el medicamento se unió a todas las proteínas PDGFRA mutadas que se probaron e inhibió la actividad de estas en las células cancerosas.
Gran respuesta con efectos secundarios poco frecuentes
En un estudio en fase inicial llamado NAVIGATOR patrocinado por Blueprint Medicines, el fabricante de avapritinib, se incluyeron a 43 personas con TEGI que tenían la mutación del exón 18 en PDGFRA; todos menos uno de los pacientes tenían enfermedad metastásica. Según los datos presentados en el congreso anual de 2019 de la Sociedad Oncológica de Tejido Conjuntivo (CTOS), de los 43 participantes, 34 (79 %) tuvieron una disminución del tamaño tumoral (respuesta parcial) y 3 (7 %) tuvieron una respuesta completa (los tumores desaparecieron por completo). En el caso de otros 5 (12 %) pacientes, los tumores dejaron de crecer (enfermedad estable). Solo uno de los participantes del estudio no respondió al tratamiento.
La mayoría de los participantes había recibido antes imatinib u otro inhibidor de la tirosina cinasa. De los 5 participantes que recibieron solo avapritinib, 2 tuvieron una respuesta completa.
La aprobación de la FDA incluye el uso del avapritinib como terapia de primera línea (tratamiento inicial). "Pienso que se anticipa que no probaremos otras cosas que no funcionarán, en su lugar, empezaremos por usar esto", puntualizó el doctor Heinrich.
Los efectos secundarios que se observaron durante el estudio clínico incluyen náuseas, cansancio y anemia (concentración de glóbulos rojos por debajo de lo normal).
Algunos efectos secundarios más graves, pero menos comunes, son el sangrado de los vasos sanguíneos en el cerebro y el deterioro cognitivo, que causan problemas de memoria y confusión. Los efectos cognitivos "son un efecto secundario infrecuente para un inhibidor de la cinasa", advirtió el doctor Heinrich, "por eso es importante que los oncólogos estén al tanto y controlen a los pacientes en forma minuciosa. En la mayoría de los pacientes, estos síntomas se tratan con cambios en la dosis o con intervalos breves en los que no reciben el medicamento".
Próximos pasos
En un estudio clínico con distribución al azar más numeroso, llamado VOYAGER, se compara el uso de avapritinib con regorafenib (Stivarga) en personas cuyos tumores TEGI presentan cualquier tipo de mutación en KIT o PDGFRA y la enfermedad progresó después del tratamiento con al menos otros dos inhibidores de la tirosina cinasa.
"Alrededor de 70 % [de los casos] son TEGI con mutaciones en KIT, pero como KIT y PDGFRA están muy relacionados, la mayoría de los medicamentos que se usan para una mutación, también sirven para la otra", explicó el doctor Heinrich. "Además, algunas de las mutaciones que determinan la resistencia en los TEGI con mutaciones en KIT... tienen un vínculo estrecho con las mutaciones en PDGFRA".
"Este [medicamento] podría tener una gran repercusión en el tratamiento de los TEGI en personas adultas", puntualizó el doctor Glod. Por desgracia, agregó el doctor Glod, es poco probable que se evalúe en TEGI infantiles, ya que estos en general surgen debido a mutaciones en otra familia de genes llamados SDH.
El doctor Heinrich explicó que para los adultos con TEGI, es probable que esta aprobación aumente la cantidad de pacientes que se hacen pruebas moleculares. "Hay otras razones por las que deberíamos estar haciendo eso, pero… ahora no queremos dejar de identificar a los pacientes con mutaciones en el exón 18", señaló.
Inclusión de la experiencia del paciente
Como parte del proceso de aprobación del avapritinib, Blueprint Medicines se embarcó en una colaboración sin precedentes con un grupo de defensa y apoyo de pacientes con TEGI llamado Life Raft Group.
Desde hace casi 20 años, el grupo coordina un registro de pacientes que reúne información sobre la experiencia de vivir con TEGI y su tratamiento. Hasta la fecha, más de 2000 personas con TEGI compartieron su información (en algunos casos, incluso muestras de tejido).
"Son todos datos notificados por los pacientes, que provienen directamente de los pacientes o los cuidadores", explicó Sara Rothschild, defensora de pacientes de Life Raft Group.
En 2016, Blueprint Medicines propuso al grupo usar su base de datos para entender cómo los pacientes con TEGI describen su experiencia de vida con el cáncer y, además, para saber cuán comunes son las pruebas de detección de mutaciones en los TEGI en los Estados Unidos.
"Deseaban entender la carga de la enfermedad, la carga del tratamiento, los beneficios y los riesgos en el control de la enfermedad", aclaró Rothschild. También explicó que, según se estipula en la Ley de Curas del Siglo XXI (21st Century Cures Act), la FDA ahora insta a los laboratorios farmacéuticos a incorporar esta perspectiva de los pacientes en sus solicitudes para la aprobación de medicamentos.
La base de datos ahora "recopila información de los pacientes que reciben avapritinib y sobre lo que hacen para controlar algunos efectos secundarios", dijo Rothchild. Life Raft Group usará esta información para crear un webinario que ayudará a los pacientes a hablar con sus médicos sobre el tratamiento.
































No hay comentarios:
Publicar un comentario