
Una puesta al día para el médico práctico | 07 OCT 18
Melanoma: diagnóstico y tratamiento
Su incidencia y mortalidad difieren mucho en todo el mundo según el acceso a la detección temprana y la atención primaria.
Autor: Dirk Schadendorf, Alexander C J van Akkooi y colaboradores Lancet 2018; 392: 971–84
Página 1
| Introducción |
Durante más de 40 años hubo pocas opciones terapéuticas, y los ensayos clínicos durante ese tiempo no tuvieron éxito. En los últimos 10 años, una mayor comprensión biológica y el acceso a sustancias terapéuticas innovadoras han transformado al melanoma avanzado en un nuevo modelo oncológico para tratar cánceres sólidos.
Los tratamientos dirigidos a las mutaciones del proto-oncogén BRaAFserina/treoninacinasa (BRAF)V600 Val600) usando inhibidores del BRAF combinados con inhibidores de proteínacinasa activada por mitógeno han mejorado significativamente la respuesta y la supervivencia general.
Por otra parte, el melanoma cutáneo avanzado se ha desarrollado en un prototipo para probar agentes moduladores de control, lo que ha aumentado la esperanza la contención prolongada del tumor y una cura potencial.
Estas expectativas han sido sostenidas por el éxito clínico con agentes específicos y anticuerpos que bloquean la proteína 1 de muerte celular programada en la enfermedad locorregional, que induce la prolongación de libre de recaídas y de metástasis a distancia, con mayor supervivencia global.
| Epidemiología |
En todo el mundo, casi el 1, 7% de los casos de cánceres primarios recién diagnosticados (excluyendo el melanoma cutáneo no cáncer) corresponde al melanoma de piel, provocando aproximadamente el 0,7% de todas las muertes anuales por cáncer.
La incidencia y las tasas de mortalidad del melanoma cutáneo difieren ampliamente en cada país. La incidencia del melanoma cutáneo ha aumentado desde principios de la década de 1970 en las poblaciones predominantemente de piel blanca.
En los países donde la incidencia está en disminución, como Australia, la mejoría se atribuye a la prevención primaria y los cambios en los estilos de vida, como la mayor tendencia a permanecer más en interiores que en el pasado.
| Factores de riesgo |
Las mutaciones genéticas son responsables de solo una pequeña proporción de casos de melanomaLos factores de riesgo establecidos para el melanoma cutáneo son la radiación ultravioleta por exposición al sol y las subsiguientes quemaduras solares, el bronceado en interiores (especialmente antes de los 35 años), la presencia de nevos melanocíticos o displásicos, antecedentes personales y familiares de melanoma cutáneo, características fenotípicas (cabello rubio, ojos y piel clara, tendencia a las pecas y, un elevado nivel socioeconómico. Así lo confirma una revisión sistemática de 34 guías de 20 países para la identificación, detección y seguimiento de individuos con alto riesgo de melanoma cutáneo primario.
Las mutaciones genéticas son responsables de solo una pequeña proporción de casos de melanoma. Los pacientes con historia personal de más de un melanoma, o con varios miembros de un lado de la familia con melanoma, o un miembro de la familia que ha tenido más de un melanoma, o un miembro de la familia que tuvo melanoma y cáncer pancreático podría haber heredado una mutación genética.
Sin embargo, aunque ya se pueden hacer análisis de las mutaciones genéticas, no se recomiendan porque no se ha demostrado que brinden un beneficio clínico. En cuanto a la exposición ultravioleta como factor de riesgo más importante de melanoma cutáneo, los datos moleculares y epidemiológicos apoyan dos mecanismos etiológicos diferentes.
La exposición temprana al sol y la propensión a los nevos, promovidas por los factores del huésped y la exposición intermitente al sol, lo que tiende a provocar un proto-oncogén B-Raf serina/treoninacinasa (BRAF) la vía propensa asociada al nevo, que se caracteriza por una edad joven en el momento del diagnóstico, ausencia de enfermedad crónica, daño cutáneo solar, melanoma con extensión superficial y aparición de melanoma en el tronco.
La exposición solar acumulada resulta en la denominada exposición solar crónica, que se caracteriza por la presencia mutaciones en el proto-oncogén NRAS, GTPasa (NRAS), sin ninguna asociación con el recuento de nevos o de restos de nevo.
| Mecanismos y fisiopatología |
Aunque la división de los melanocitos es rara (menos de 2 veces/año), el índice proliferativo aumenta constantemente a medida que los neoplasmas evolucionan secuencialmente, un proceso
La mayor progresión de las lesiones intermedias y de los melanomas in situ requiere mutaciones adicionales. Para ganar potencial invasivo son necesarias mutaciones de diferente complejidad, sobre todo de los genes que controlan el ciclo celular y la remodelación de los cromosomas.
También intervienen mecanismos inmunosupresores relacionados con factores de crecimiento tumorales y el complejo mayor de histocompatibilidad.
| Clasificación del melanoma y alteraciones genéticas |
El melanoma se diagnostica histopatológicamente y luego se trata de acuerdo con la clasificación histológica y el cálculo de riesgo. La clasificación tiene en cuenta: el espesor del tumor (etapa T de la estadificación de Breslow), participación de 28 ganglios linfáticos (etapa N) y presencia de metástasis (etapa M).
La mayoría de los melanomas son diagnosticados antes de la aparición de un ganglio linfático o una metástasis a distancia (etapa N0 y M0). Según Breslow, el criterio más importante para evaluar el pronóstico y posterior tratamiento, incluyendo los márgenes de seguridad requeridos y la biopsia del ganglio linfático centinela, es el grosor del tumor.
La ulceración es otro marcador histopatológico relevante que se asocia en forma independiente con un mal pronóstico, y también es incorporado en la etapa T.
La clasificación del American Joint Committee on Cancer fue actualizada en 2017. Histopatológicamente, los recuentos mitóticos ya no son relevantes para la estadificación mientras que la profundidad del tumor se redondea a décimas de milímetros.
La predicción de la supervivencia del paciente, particularmente en las etapas de melanoma de bajo riesgo, ha mejorado. Los tumores se clasifican con menos frecuencia como etapa 2, y más frecuentemente como etapa 3.
Los nuevos enfoques terapéuticos, incluyendo los tratamientos adyuvantes más efectivos, probablemente en el futuro darán como resultado una mejor tasa de supervivencia específica adicional del melanoma.
También se pueden distinguir diferentes subtipos histológicos de melanoma, como el melanoma de dispersión superficial nodular, el lentiginoso acral y el lentigo maligno. Sin embargo, estos tipos tumorales son menos importantes para establecer el pronóstico y el tratamiento adicional.
| Clasificación TNM de la American Joint Committee on Cancer, 8ª edición, manual de preparación, 2017 | |
| Clasificación T | |
| T1 | |
| A | <0,8 mm de espesor, sin ulceración |
| B | 0,8-1 mm de grosor (<0, 8 mm con ulceración |
| T2 | |
| A | > 1-2 mm de grosor, sin ulceración |
| B | > 1-2 mm de espesor con ulceración |
| T3 | |
| A | >2-4 mm de grosor, sin ulceración |
| B | > 2-4 mm de espesor con ulceración |
| T4 | |
| A | > 4 mm de espesor, sin ulceración |
| B | > 4 mm de espesor con ulceración |
| Clasificación N | |
| N0 | No afecta a los ganglios linfáticos regionales |
| N1a-c | Un ganglio linfático afectado, micrometástasis o macrometástasis o, metástasis en tránsito o satélite |
| N2a-c | 2-3 ganglios linfáticos afectados, o al menos un ganglio linfático afectado y en tránsito o metástasis satélite. |
| N3a-c | Al menos 4 ganglios linfáticos afectados o al menos 2 ganglios linfáticos afectados y ganglios enmarañados. |
| Clasificación M | |
| M0 | Sin evidencia de metástasis a distancia |
| M1 | |
| a | Metástasis a distancia en la piel |
| b | Metástasis a distancia en el pulmón |
| c | Metástasis distante no del SNC |
| d | Metástasis del SNC |
| Estadío | Clasificación T | Clasificación N | Clasificación M |
| 0 | T | N0 | M0 |
| 1A | T1a o T1b | N0 | M0 |
| 1B | T2a | N0 | M0 |
| 2A | T2a o T3a | N0 | M0 |
| 2B | T3, T4, o T4b | N0 | M0 |
| 2C | T0 | N1b y N1c | M0 |
| 3A | T1a-b a T2a | N1a de N2a | M0 |
| 3B | T0 | N2b, N2C, N3b, o N3c | M0 |
| 3B | T1a-b a T2a | N1b-c o N2b | M0 |
| 3B | T2b - T3a | N1a-N2b | M0 |
| 3C | T1a-T3a | N2c o N3a-c | M0 |
| 3C | T3b-T4a | Todo N N1 | M0 |
| 3C | T4b | N1-N2c | M0 |
| 3D | T4b | N3a-c | M0 |
| 4 | Todo T y tis | Todo N | M1 |
| Tabla 2: Estadios histopatológicos según el American Joint Committee on Cancer, Manual de Preparación, 8º Edición, 201730 | |||
| Clasificación genética |
Otras mutaciones adicionales o pérdidas de genes se detectan frecuentemente en las lesiones borderline mientras que en el melanoma se observan alteraciones genéticas múltiples.
Se han distinguido 4 diferentes subtipos de melanoma genético, según la activación de las mutaciones genéticas: melanoma mutante BRAF (50% de los melanomas); melanomas mutantes N-Ras, K-Ras y H-Ras (representan alrededor del 25% de los melanomas; melanomas mutantes NF1 (casi el 15% de los melanomas) y, melanomas triples de tipo salvaje (casi el 10% de los melanomas).
Otras alteraciones genéticas frecuentes dan cuenta del 30 al 80% de los melanomas. Adicionalmente, es frecuente la alteración de varios supresores de tumores, incluyendo CDKN2A, PTEN, TP53 y ARID2. La frecuencia de las mutaciones y alteraciones en el número de copias varía considerablemente según el tipo de melanoma.
Las mutaciones BRAF son más comunes (50-60%) en los melanomas cutáneos, que se originan en la piel con daño intermedio. Las mutaciones BRAF son raras y ocurren con frecuencia en los melanomas que aparecen en sitios de piel muy dañada, como así mucosas y partes acras (extremidades, dedos, orejas).
Los melanomas acrales no expuestos a los rayos ultravioleta y los mucosos tienen muchas menos mutaciones pero con mayor frecuencia tienen alteraciones cromosómicas.
| Marcadores moleculares de pronóstico y tratamiento |
A pesar de ser muy controvertida, la prueba más utilizada para predecir la respuesta terapéutica es la prueba inmunohistoquímica de la expresión del ligando 1 de muerte programada (del inglés: PD-L1), que está claramente asociado con la tasa de respuesta, la supervivencia libre de progresión y la supervivencia global en el melanoma. Sin embargo, en la mayoría de los casos, esta prueba no influye en las decisiones terapéuticas.
Los enfoques genéticos que estiman la respuesta a la inmunoterapia estableciendo neoepítopes o la carga de mutaciones generales aún son experimentales, y no se usan en la práctica clínica.
| Cribado y diagnóstico clínico |
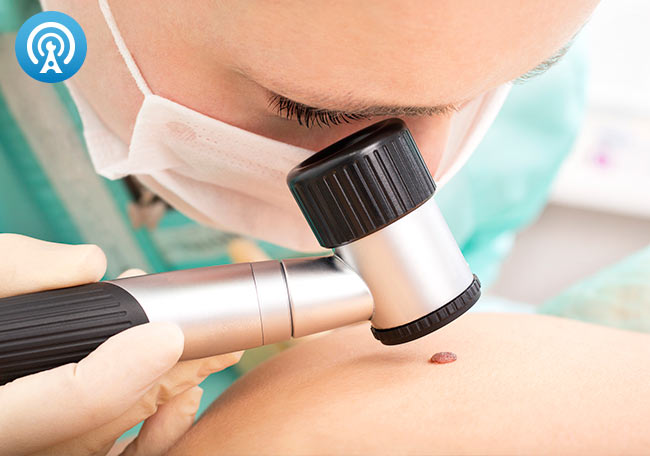
La detección del melanoma incluye el examen cutáneo de todo el cuerpo, mediante la dermatoscopia u otras técnicas de imagen> Cribado y vigilancia del melanoma
Las personas con un mayor riesgo de melanoma (piel blanca, lunares atípicos múltiples o historia familiar de melanoma) deben ser examinadas periódicamente. Las poblaciones y métodos de detección difieren en cada país, y a menudo no hay pautas exactas.
En general, la detección del melanoma incluye el examen cutáneo de todo el cuerpo, mediante la dermatoscopia u otras técnicas de imagen.
La detección generalmente no está restringida al melanoma, y es útil para la detección temprana de todos los tipos de cánceres de piel, incluyendo la biopsia y el diagnóstico histopatológico, en los casos de lesiones sospechosas.
La ventaja de las evaluaciones regulares de cáncer de piel es que pueden conducir al diagnóstico de melanomas de menor profundidad invasiva que los melanomas detectados por los pacientes u otros cuidadores.
Sin embargo, se ha argumentado que los exámenes regulares conducen a un sobrediagnóstico de melanomas delgados, sin un efecto sobre la supervivencia del paciente.
A este fin, el beneficio del cribado regular sobre la mortalidad por melanoma aún no se ha demostrado, y no se han hecho ensayos aleatorizados del cribado regular del cáncer de piel versus ninguno. Por lo tanto, se espera que en los próximos años se cuente con programas de cribado del cáncer de piel.
Muchas guías clínicas recomiendan que las personas en alto riesgo de melanoma reciban vigilancia regular para mejorar la supervivencia a través de la detección temprana y la reducción de las escisiones innecesarias.
| Diagnóstico clínico |
La técnica más utilizada es la dermatoscopia, también conocida como microscopia de epiluminiscencia, una lupa portátil que utiliza una fuente de luz para inspeccionar las lesiones cutáneas no oscurecidas por los reflejos de la superficie cutánea.
La utilización de la dermatoscopia requiere una capacitación considerable, pero cuando se utiliza en forma apropiada mejora sustancialmente el diagnóstico de las lesiones poco claras o dudosas, que hacen sospechar el melanoma.
Esta técnica fácil de usar puede ser adicionalmente equipada con un dispositivo de digitalización, permitiendo el almacenamiento y la comparación de las imágenes dermatoscópicas a lo largo del tiempo (dermatoscopia videodigital).
Esta metodología ha demostrado reducir los procedimientos quirúrgicos innecesarios de las lesiones benignas, y para detectar los melanomas de apariencia clínicamente atípica.
Otras técnicas de imagen, como la microscopía láser confocal por reflectancia in vivo, el análisis digital multiespectral asistido por computadora y, la espectroscopía de impedancia eléctrica están disponible para ayudar al médico en la diferenciación de los melanomas y las lesiones benignas precursoras.
En general, casi el 70% de los melanomas son diagnosticados correctamente por la inspección clínica de un dermatólogo mientras que usando la dermatoscopia puede alcanzar el 90%. Aproximadamente el 10% de los melanomas no son detectados de manera confiable por estos métodos.
Después del diagnóstico histopatológico de un melanoma invasivo se realiza el examen de los ganglios linfáticos regionales, mediante la palpación y la ecografía, previo a otros procedimientos quirúrgicos, para excluir la propagación macroscópica metastásica por vía linfática.
Ante cualquier evidencia de metástasis, o en los pacientes con tumores primarios de alto riesgo que han invadido los tejidos hasta una profundidad de al menos 4 mm, es necesario realizar radiografías, TC o IRM para excluir la propagación metastásica a distancia.
| Tratamiento |
Varios estudios que analizaron márgenes de seguridad estrechos versus márgenes amplios hallaron menos recurrencias locales con los márgenes más amplios, pero sin modificaciones de la supervivencia general.
Luego de diferentes resultados de algunos estudios, se concluyó que las modificaciones obtenidas con márgenes de seguridad reducidos son aceptables para áreas funcionales (es decir, melanomas en las articulaciones) o por razones estéticas (melanomas faciales).
La disección electiva del ganglio linfático no mostró ningún beneficio significativo y por lo tanto, no se recomienda. La biopsia del ganglio centinela se recomienda para los melanomas de al menos 1,0 mm.
En el melanoma primario <1,0 mm, la biopsia solo se considera si existen factores de riesgo adicionales, como ulceración y edad joven simultáneos.
La estadificación del ganglio centinela es considerada de alta relevancia para la estadificación adecuada, la primaria del riesgo y potencialmente, también para elegir el seguimiento y la estrategia terapéutica adyuvante correctos.
Un estudio de pacientes con melanomas de nivel intermedio y grueso no mostró ningún beneficio en la supervivencia después de un seguimiento prolongado de los resultados de la escisión local amplia con biopsia del ganglio linfático centinela versus la escisión local amplia con solo la observación del ganglio centinela.
Hasta 2017, la disección completa de los ganglios linfáticos en los pacientes con biopsia del ganglio centinela era considerada el tratamiento más adecuado. Sin embargo, 2 estudios (German DeCOG-SLT e International MSLT-2) no hallaron ningún beneficio significativo en la supervivencia específica del melanoma comparado con la disección completa rutinaria de los ganglios y la observación ecográfica periódica del ganglio centinela.
La disección completa de los ganglios linfáticos mejoró la supervivencia ganglionar regional libre de recidiva, pero no la supervivencia global y la supervivencia libre de recaídas. (SLR).
La disección ganglionar completa proporciona información para la estadificación adicional, porque casi el 20% de los pacientes con una biopsia del ganglio centinela positiva tendrá la participación adicional de otros ganglios no centinela, que pueden ser hallados por la disección completa de los ganglios linfáticos.
Sin embargo, esta información adicional no conduce necesariamente a una mejor estadificación, porque solo un máximo del 6% de los pacientes posteriormente pasa a una etapa superior. Por lo tanto, no está indicada la disección completa inmediata de los ganglios linfáticos debido a la positividad de la biopsia de un ganglio linfático centinela.
Finalmente, la conducta estándar para los casos de enfermedad regional clínicamente detectable (macroscópica, sin ganglio centinela) es la disección terapéutica de los ganglios linfáticos. En el futuro, los resultados de los tratamientos neoadyuvantes podrían conducir a una cirugía menos extensa (y por lo tanto a una menor morbilidad subsecuente) en las personas que tienen una respuesta completa.
| Tratamiento adyuvante |
Un metaanálisis de ensayos que investigaron la eficacia del tratamiento con interferón-α versus ningún tratamiento reveló un efecto significativo en la SLR, pero solo un pequeño beneficio en la supervivencia general, con un 3% en la supervivencia después de 5 años.
El ensayo EORTC-1807187 sobre el uso adyuvante con ipilimumab (10 mg/kg durante 3 años) comparado con placebo en 951 pacientes con melanoma en estadio 3 mostró una clara mejoría de la supervivencia libre de recaída y supervivencia global, estableciendo un régimen activo para el tratamiento adyuvante del melanoma en estadio 3. Según estos resultados, la FDA (Food and Drug Administration) de EE. UU. licenció al ipilimumab para los pacientes con melanoma en estadio 3 después de la linfadenectomía.
El esquema con ipilimumab mostró toxicidad sustancial, incluida la amenaza para la vida por eventos autoinmunes y muertes relacionadas con el tratamiento. Por lo tanto, el estudio intergrupal estadounidense ECOG-160989 comparó el uso de 10 mg/kg de ipilimumab versus 3 mg/kg durante solo 1 año, y los resultados preliminares indican que no hay diferencia para la SLR.
Un metaanálisis mostró que la SLR es un marcador sustituto válido para la supervivencia si la razón de riesgo (Hazard ratio) para la SLR es ≤ 0,77. Otro estudio en pacientes con melanoma en etapa 4 y un seguimiento medio de 1,6 años comprobó que 3 mg/kg de nivolumab (un medicamento nuevo), cada 2 semanas durante 1 año, comparado con 10 mg/kg de ipilimumab (un medicamento ya aprobado) cada 3 semanas, en pacientes con estadios 3B, 3C y melanoma en estadio 4 resecado, mejoró significativamente la SLR, en todos los subgrupos.
El nivolumab mostró una tolerancia excelente con solo 4% de interrupciones relacionadas con el tratamiento versus el 30% debidas al ipilimumab. En diciembre de 2017, la FDA aprobó al nivolumab como adyuvante, como así en Europa en agosto de 2018.
Los resultados de otro ensayo aleatorizado del anticuerpo anti PD-1 pembrolizumab versus placebo en pacientes con melanoma en estadio 3, publicado en abril de 2018 mostró que el pembrolizumab brindó un beneficio claro en la SLR en comparado con el placebo, después de una mediana de seguimiento de 15 meses.
El primer uso de terapias adyuvantes dirigidas en pacientes con mutaciones BRAFV600E/K fue publicado después de una mediana de seguimiento de 2,8 años. El uso combinado de dabrafenib y trametinib en pacientes con melanoma en estadio 3A-C no solo mostró un beneficio en la SLR sino también en la supervivencia general, comparado con el placebo oral.
Se destaca que no hubo toxicidades inesperadas con el uso de inhibidores de BRAF-MAPK cinasa. Un estudio que comparó vemurafenib con placebo no mostró resultados favorables con el tratamiento en monoterapia con un inhibidor del BRAF.
| En conclusión, en 2018, el nivolumab (para todos los casos) y la combinacióndabrafenib/trametinib (para los pacientes con melanoma por mutación de BRAF) se convertirán en los nuevos estándares de tratamiento del melanoma en etapa 3. |
| Combinaciones de inhibidores de cinasas usados frecuentemente en el tratamiento del melanoma | |
| Tipo de inhibidor | |
| Dabrafenib combinado con trametinib | |
| Dabrafenib* inhibidor BRAF | 150 mg oral 2 veces/día |
| Trametinib* inhibidor MEK | 2 mg oral 1 vez/día |
| Vemurafenib combinado con cobimetinib | |
| Vemurafenib* inhibidor BRAF | 960 mg oral 2 veces/día |
| Cobimetinib* inhibidor MEK | 60 mg oral 1 vez/día (día 1-21) repetir día 29 |
| Encorafenib combinado con binimetinib | |
| Encorafenib† inhibidor BRAF | 450 mg oral 1 vez/día |
| Binimetinib† inhibidor MEK | 45 mg oral 2 veces/día |
| Imatinib combinado con nilotinib | |
| Imatinib ‡ inhibidor KIT | 40-80 mg oral 1 vez/día |
| Nnilotinib ‡ inhibidor KIT | 400 mg oral 2 veces/día |
| Enfermedad metastásica |
Para el melanoma BRAFv600 mutado, los inhibidores de la cinasa orales, de molécula pequeña, ya están aprobados para el tratamiento de elección de la enfermedad localmente avanzada y metastásica.
Varios ensayos clínicos aleatorizados en fase 3 han demostrado una tasa de respuesta objetiva a los inhibidores de BRAF sin precedentes, de aproximadamente el 50%, que podría aumentar al 70% cuando se usen los inhibidores de MEK combinados.
Aunque las respuestas completas solo fueron comprobadas en el 16% de los pacientes, la tasa de control de la enfermedad (respuesta completa, respuesta parcial, o enfermedad estable) excedió el 90%, lo que significa que, inicialmente, todos los pacientes se benefician con este tratamiento.
Por otra parte, dado que la mediana de la SLR aumentó de 7-9 meses con los inhibidores de BRAF como agente único a 11-14,9 meses con los inhibidores de BRAF y MEK, la terapia combinada se ha convertido en un régimen estándar establecido.
Otro efecto positivo de agregar un inhibidor de MEK fue la reducción de la activación paradójica de la vía MAPK por un inhibidor BRAF en monoterapia, dando como resultado menor toxicidad cutánea y menos desarrollo de lesiones de cáncer de piel no melanoma.
Actualmente, existen 2 combinaciones de inhibidores de BRAF-MEK: vemurafenib/cobimetinib, y dabrafenib/trametinib. En breve, se espera otra combinación, encorafenib/binimetinib. Esencialmente, los datos de eficacia para estas combinaciones son altamente comparables, mientras que su farmacocinética y perfil de toxicidad difieren en algunos aspectos.
Por ejemplo, la combinación vemurafenib-cobimetinib puede tomarse con o sin comida y más comúnmente se asocia con mayor fotosensibilidad, mientras que dabrafenib/trametinib debe tomarse en ayunas y más comúnmente se asocia con pirexia, la que es la razón más común de interrupción del tratamiento y la modificación de las dosis.
Una característica típica de todas las terapias basadas en inhibidores de BRAF es una respuesta rápida, de días a algunas semanas, independientemente de la carga tumoral y de la localización de metástasis de melanoma sintomático con tumores de progresión rápida. Por otra parte, se ha demostrado que dabrafenib/trametinib es eficaz en las metástasis cerebrales de melanoma, con tasas de respuesta intracraneana de hasta 55%.
Cuando se aplica radioterapia concurrente con un inhibidor de BRAF se debe tener precaución, porque aumenta la toxicidad (dermatitis severa, radionecrosis, proliferación quística folicular). La mediana de la supervivencia global en pacientes con melanoma en estadio 4 no tratado o tratado con un inhibidor de BRAF y un inhibidor de MEK es de 22-25 meses, con un 40% de supervivencia general a los 3-5 años.
La presencia de concentraciones de lactato deshidrogenasa normales, menos de 3 sitios metastásicos y un puntaje en la escala de del Eastern Cooperative Oncology Group se asoció con un pronóstico favorable. Sin embargo, uno de los principales problemas con la terapia dirigida al melanoma por BRAF-mutado es el desarrollo de resistencia durante el período de tratamiento.
Se han identificado muchos mecanismos de resistencia a los inhibidores de BRAF y MEK que finalmente conduce a la reactivación de la señalización de la vía MAPK o la activación de la vía PI3K-AKT. Entre estos mecanismos, los mejor descritos son las amplificaciones del gen BRAF y MEK1 y las mutaciones MEK2. El tratamiento combinado inhibidor de BRAF/inhibidor de MEK tiene un buen perfil de seguridad y tolerancia.
Los efectos adversos comunes son los síntomas gastrointestinales (náuseas, diarrea, vómitos, artralgias, fatiga, fotosensibilidad, aumento de creatinacinasa y de las transaminasas hepáticas, pirexia, edema periférico, cefalea, erupción, alopecia, hiperqueratosis y reacciones cutáneas palmoplantares.
Aunque la retinopatía, la disfunción cardíaca ventricular izquierda y la prolongación del intervalo QT son efectos adversos menos comunes, se necesita una supervisión estrecha. Es común que la combinación inhibidor BRAF/MEK provoque eventos adversos, pero en general no requiere la suspensión del tratamiento.
Para pacientes con melanoma de BRAF tipo salvaje, las opciones para terapias dirigidas son escasas, y el tratamiento dirigido para el melanoma BRAF de tipo salvaje no es una opción de primera línea.
Especialmente Para esta población de pacientes que no responden a la inmunoterapia se requieren nuevos agentes o combinaciones. En los subgrupos raros de melanomas con mutación de la tirosinacinasa del receptor del protooncogén KIT, los inhibidores de la tirosinacinasa con potente inhibición de c-kit ?:mesilato de imatinib, dasatinib, malato de sunitinib y nilotinib ? han mostrado algo de actividad clínica en casos seleccionados y en pequeños ensayos clínicos. Sin embargo, dicen los autores, la duración de la respuesta que se obtiene suele ser corta.
> Bloqueo del punto de control del melanoma en estadio 4
El mejoramiento de la terapia sistémica para el melanoma avanzado ha sido impulsado por los inhibidores del punto de control contra CTLA4 (ipilimumab) y PD-1(pembrolizumab y nivolumab). El melanoma es la indicación principal para la aprobación de los inhibidores del punto de control debido a su mayor eficacia comparada con la quimioterapia.
En estudios realizados, el ipilimumab aumentó el porcentaje de supervivencia a largo plazo (>3 años) en pacientes con melanoma metastásico a alrededor del 20%.Esos estudios también informaron una variedad de efectos secundarios inflamatorios asociados con este tratamiento, denominados eventos adversos relacionados con el sistema inmune.
El ipilimumab afecta principalmente al aparato gastrointestinal (colitis y diarrea), la piel (dermatitis y prurito), el hígado (hepatitis y aumento de las pruebas de función hepática), los órganos endocrinos (hipofisitis y tiroiditis), dependiendo de la dosis. Luego, se desarrollaron guías para monitorear y manejar los efectos adversos provocados por el ipilimumab.
Se investigó la acción del nivolumab y el pembrolizumab dirigidos al punto de control de PD-1, y se halló mayor eficacia en comparación con el ipilimumab y la quimioterapia, con menores tasas de toxicidad. Los eventos adversos relacionados con el sistema inmune derivados del uso de inhibidores de PD-1 afectan con mayor frecuencia al pulmón (neumonitis) y la glándula tiroides (hipertiroidismo o hipotiroidismo) que el ipilimumab.
Varios grupos han desarrollado guías para tratar y monitorear los eventos adversos relacionados con el sistema inmune por el uso de PD-A. en el melanoma metastásico. Varias guías recomiendan el nivolumab (3 mg/kg, c/2 semanas o una dosis fija de 480 mg c/4 semanas) y el pembrolizumab (2 mg/kg, c/3 semanas o una dosis fija de 200 mg c/3 semanas). Por otro lado, otras guías, como la National Comprehensive Cancer Network, recomiendan el uso preferencial de un inhibidor de la PD-1 sobre el ipilimumab.
Un estudio importante en fase 3 (Checkmate-067) mostró que el nivolumab seguido de ipilimumab también fue superior al efecto de ambos fármacos en monoterapia. Sin embargo, los eventos adversos grado 3 y 4 relacionados con el tratamiento ocurrieron en el 56% de los pacientes, mientras que el 30% de los pacientes debió suspender el nivolumab y el ipilimumab debido a los eventos adversos.
La calidad de vida relacionada con la salud fue comparable en los grupos tratados con nivolumab solo y con nivolumab e ipilimumab. Se recomienda un monitoreo más intenso para la terapia combinada que para la monoterapia. Actualmente, tanto la monoterapia con inhibidores de PD-1 como la combinación de nivolumab/ipilimumab son considerados el estándar de atención.
No obstante, debido a que los múltiples eventos adversos sistémicos relacionados con la inmunoterapia son más comunes e irreversibles durante la terapia combinada que con la monoterapia anti PD-1, todavía existe un gran debate con respecto a quiénes requieren terapia combinada.
Esta terapia parece ser más eficaz en los pacientes con factores pronósticos deficientes, como el aumento de la concentración de lactato deshidrogenasa, el melanoma de la mucosa como tumor primario, las metástasis cerebrales asintomáticas, la expresión de PD-L1 en menos del 1% de las células de melanoma.
Casi el 60% de los pacientes muestra resistencia primaria (de novo) a la inhibición del punto de control PD-1, mientras que el 20-30% de los respondedores iniciales desarrollarán resistencia secundaria (adquirida).
Cuando se conozcan mejor los biomarcadores predictores de resistencia se prodrá desarrollar mejores estrategias terapéuticas, y de mayor eficacia. Hasta ahora, no existen biomarcadores para ser usados rutinariamente en la clínica.
Algunos posibles biomarcadores que evalúan el reconocimiento inmunológico de las células tumorales son: la carga mutacional y la expresión de neoantígenos y, la presencia de un entorno tumoral inmune-permisivo, como la expresión de PD-L1, la presencia y ubicación de linfocitos infiltrantes tumorales o la actividad de la vía de señalización del interferón-γ en las células tumorales. La composición del microbioma intestinal y de otros sitios también puede representar un biomarcador de la eficacia de los inhibidores del punto de control.
| Conclusión |
Los pacientes con carga tumoral elevada, metástasis cerebrales y concentraciones de lactato deshidrogenasa elevadas todavía tienen mal pronóstico (supervivencia a los 3 años <10%). Hay un gran interés en combinar agentes activos, independientes de su modo de acción.
Una estrategia utilizada en estudios clínicos en fase 3 es combinar inhibidores de MEK con o sin inhibidores de BRAF, con inhibidores del punto de control (bloqueantes PD-1 o anticuerpos bloqueantes PD-L1).
Otra estrategia es enfocarse en la aplicación de anticuerpos anti PD-1 como estándar de atención, agregando otros moduladores inmunológicos o moduladores de microambiente como los anticuerpos anti LAG3, que también están en estudio de fase 3.
En el contexto adyuvante y metastásico, particularmente cuando se usan inhibidores del punto de control, se desconoce la duración óptima del tratamiento. Por otra parte, numerosos ensayos clínicos están investigando otras moléculas, generalmente con el uso estándar de anticuerpos anti PD-1 o inhibidores de BRAF-MEK.
También faltan respuesta para saber si siempre es necesaria una combinación completa para el tratamiento de primera línea (con toda su toxicidad) o si la administración de un medicamento después del otro (enfoque secuencial) podría mejorar la supervivencia.
Todavía hay varios desafíos importantes para tratar el melanoma metastásico. Por último, falta desarrollar opciones terapéuticas para los pacientes que inicialmente no responden a la terapia sistémica y así aumentar el número de sobrevivientes a largo plazo
Resumen y comentario objetivo: Dra. Marta Papponetti
Contenidos relacionados
Los editores le recomiendan continuar con las siguientes lecturas:
































No hay comentarios:
Publicar un comentario