
La FDA otorga otra aprobación que afianza la función de la genómica en el tratamiento del cáncer
, por el doctor Norman E. Sharpless
La aprobación reciente de otro medicamento por parte de la Administración de Alimentos y Medicamentos (FDA) marca un hito en el tratamiento del cáncer. Con esta aprobación de la FDA, se amplía la lista creciente de usos autorizados para el inhibidor de puntos de control inmunitario pembrolizumab (Keytruda).
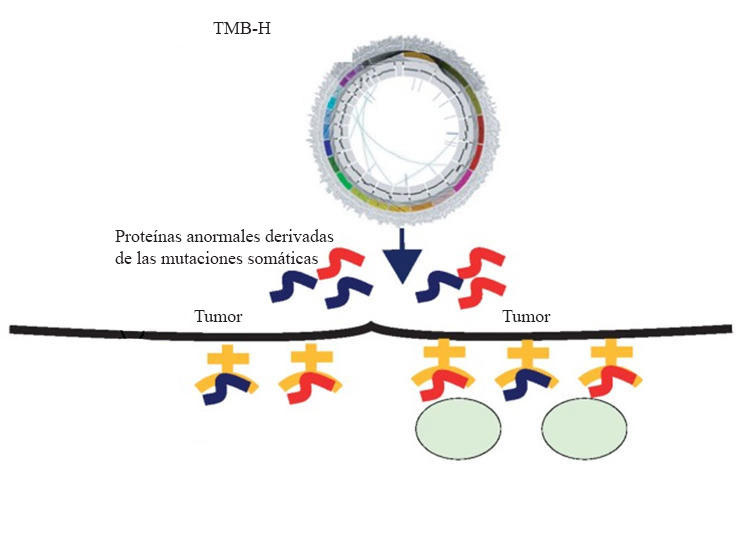
Esta vez, se aprobó para tratar a algunos adultos y niños con cáncer avanzado de cualquier tipo que presenta un tumor con gran número de mutaciones genéticas, lo que también se llama un cáncer con carga mutacional del tumor alta (TMB-H).
La aprobación acelerada significa que el pembrolizumab se deberá confirmar mediante estudios adicionales. También hay otros factores que los oncólogos deben considerar en el momento de decidir si el tratamiento es una buena opción para el paciente. Luego trataremos este tema.
Desde una perspectiva amplia, esta nueva aprobación representa la continuación de la marcha hacia el uso de la genómica para orientar el tratamiento del cáncer, incluso en los niños.
Refuerza que, como parte de su rutina, los oncólogos deberían conversar sobre las pruebas genómicas (o “secuenciación”) de tumores con los pacientes cáncer avanzado, en especial, los que no cuentan con opciones eficaces de tratamiento estándar. Las pruebas genómicas no solo se usan para buscar marcadores como la TMB que podrían pronosticar la respuesta a las inmunoterapias, sino también para las alteraciones genéticas. Es decir, tal vez sería posible identificar a las personas que se benefician de una determinada terapia dirigida al cáncer.
Este tipo de caracterización molecular ayuda a pacientes de muchos tipos de cánceres, incluso los que son difíciles de tratar como los de encéfalo y páncreas, porque se identifican terapias más eficaces y menos tóxicas. Pero también es importante señalar que la caracterización molecular tiene limitaciones considerables. Es claro que hay muchos pacientes que no se benefician de este tipo de pruebas.
Con esta nueva aprobación del pembrolizumab, la FDA aprueba por cuarta vez un medicamento para uso en cualquier tipo de tejido, solo a partir de los resultados de una prueba molecular. Como ahora hay muchas terapias aprobadas para el cáncer que exigen el uso de pruebas genómicas (pruebas diagnósticas con fines terapéuticos o “acompañantes”), pienso que se debería considerar el uso de la caracterización genómica en todos los pacientes con cánceres avanzados para los que aún no hay tratamientos eficaces.
Estas pruebas genómicas cobran cada vez más importancia en la atención del cáncer. Pero cabe destacar que muchos pacientes no se benefician de las terapias moleculares dirigidas porque nunca les ofrecen estas pruebas.
Por ejemplo, en una revisión reciente de casos de cáncer de pulmón, un tipo de cáncer para el que las pruebas genómicas son muy decisivas para elegir los tratamientos más adecuados, se observó que entre el 10 % y el 40 % de los pacientes no se hicieron las pruebas para identificar alteraciones moleculares que pronostican la respuesta a las terapias aprobadas por la FDA. Esto sucede a pesar de que se recomiendan en las pautas clínicas.
Es preocupante que no se usen estas pruebas moleculares que quizás permitan identificar tratamientos que prolongan de forma notable la vida de los pacientes. En el NCI, nos preocupa en especial que el uso escaso de las pruebas genómicas en los pacientes de poblaciones desatendidas lleve a un aumento en las desigualdades por cáncer que ya existen.
Lo que aprendimos acerca del cáncer y la carga mutacional del tumor
Tener un tumor con una carga mutacional alta (TMB-H) no es garantía de que el pembrolizumab sea eficaz. Sin embargo, presenta una buena oportunidad, según los datos de comprobación científica sólidos que se obtuvieron, en parte, gracias a la investigación financiada por el NCI.
También es importante aclarar que esta no es la primera vez que la FDA aprueba el pembrolizumab para su uso en cualquier tipo de tejido. En mayo de 2017, se aprobó para el tratamiento de cualquier tipo de cáncer con alteraciones genéticas específicas que afectan la capacidad de reparación del ADN de la célula, que se llaman tumores con inestabilidad microsatelital alta (MSI-H). La MSI-H y la TMB-H se relacionan porque en la mayoría de los tumores con MSI-H se observa también un aumento de TMB. Sin embargo, no ocurre lo contrario: muchos tumores con TMB-H no tienen MSI-H.
Es más, no hace falta una secuenciación tumoral extensa para establecer la presencia o ausencia de la MSI, mientras que esta es necesaria para determinar la TMB. Es decir, tener un medicamento aprobado según la TMB es importante, porque es más común en los tumores que la MSI-H. Esto ayuda a promover mejor la adopción de las pruebas genómicas tumorales.
Las células cancerosas con MSI-H o TMB-H tienden a producir numerosas proteínas mutadas, que suelen aparecer en la superficie celular como “neoantígenos” (antígenos recién formados). Como las células normales no presentan estas proteínas mutadas, la producción de neoantígenos tal vez sea una señal que captura la atención del sistema inmunitario. Esto, a su vez, aumenta la probabilidad de que los tratamientos con medicamentos como el pembrolizumab, que fortalecen la respuesta inmunitaria antitumoral, ayuden a las células a destruir los tumores.
La FDA otorgó la nueva aprobación a partir del estudio clínico llamado KEYNOTE-158. En este estudio, casi el 30 % de los pacientes que presentaban tumores con TMB-H respondieron al tratamiento (es decir, el tumor se achicó por lo menos el 30 %) y esto incluyó a pacientes cuyos tumores desaparecieron por completo. Por el contrario, solo 6 % de los pacientes sin TMB-H respondieron al pembrolizumab. ¡En la mitad de los pacientes que respondieron al tratamiento, los tumores no volvieron a crecer hasta por lo menos 2 años después!
Aunque los pacientes en el estudio KEYNOTE-158 no se asignaron al azar a terapias alternativas ni placebo, este tipo de respuesta estable al tratamiento en los pacientes con tumores sólidos es sumamente infrecuente con el uso de quimioterapias estándar.
Además, la mayoría de los participantes de KEYNOTE-158 recibieron muchas terapias anteriores y ya no tenían opciones eficaces para tratar su cáncer. Cabe destacar esto, porque la nueva aprobación que otorgó la FDA es solo para las personas con cáncer avanzado que no tienen otra opción de tratamiento estándar.
En general, los tumores en los niños y los adultos jóvenes no presentan muchas mutaciones y por eso tampoco es probable que tengan TMB-H. Pero algunos de los tumores en los niños tienen TMB-H, y la aprobación de este medicamento significa que estos pacientes jóvenes ahora cuentan con una nueva e importante opción de tratamiento.
Aporte de la investigación genómica
Es muy gratificante saber que la investigación financiada por el NCI ayudó a identificar la TMB como un marcador de la respuesta a la inmunoterapia.
Por ejemplo, aunque el concepto de la TMB ni siquiera existía en el momento en que se inició el Atlas del Genoma del Cáncer (TCGA), los investigadores emplearon en primer lugar los datos del TCGA para analizar a gran escala la relación entre el número de mutaciones tumorales y la respuesta a la inmunoterapia. Este es otro ejemplo de la importancia de establecer conjuntos de datos de investigación grandes, de alta calidad y diversos que se divulgan al público y generan conocimientos inesperados que resultan en adelantos importantes en el tratamiento.
Además, el NCI mantiene desde hace tiempo una exitosa alianza con Foundation Medicine, la empresa que creó FoundationOne CDx, la prueba usada para identificar a pacientes que presentan tumores con TMB-H que llevó a esta aprobación. Los investigadores subvencionados por el NCI hicieron aportes importantes a la creación de las técnicas empleadas para la prueba.
Sin embargo, como es de esperar, se trata de un área de investigación sumamente compleja. Incluso con las mejores pruebas, medir la TMB y decidir lo que significa esta medición para cada paciente, en especial, calcular la probabilidad de que responda a la inmunoterapia, no es tarea sencilla.
Por este motivo, el NCI trabaja desde otros frentes a fin de lograr más avances que respalden el uso de la TMB, la MSI y de otros biomarcadores para orientar las decisiones de tratamiento. Por ejemplo, el NCI colabora con Friends of Cancer Research y otras organizaciones en el Proyecto de Harmonización de la TMB, cuya meta es estandarizar la forma en que se mide la carga mutacional del tumor mediante distintas técnicas y enfoques. Este proyecto ayudará a asegurar que la TMB se use con la mayor eficacia posible para guiar las decisiones sobre la atención del paciente.
El NCI también financia la Misión contra el Cáncer (Cancer MoonshotSM), por la que se investiga el efecto que tienen la TMB y otros biomarcadores en la respuesta de los pacientes a la inmunoterapia. Esta actividad la realizan investigadores que son integrantes de los Centros de Vigilancia y Análisis de Inmunoterapias para el Cáncer (CIMAC) y de una alianza entre múltiples instituciones públicas y privadas llamada Colaboración para Acelerar las Terapias del Cáncer (PACT).
Son buenas noticias, pero queda mucho que aprender
Esta nueva aprobación es muy alentadora y tendrá consecuencias inmediatas en la atención del paciente. Sin embargo, es importante recalcar que identificar la presencia de la TMB es solo parte de la información sobre un tumor. Esta información será útil para el tratamiento según una serie de factores, como la capacidad física y la voluntad del paciente de tolerar más tratamientos.
En KEYNOTE-158, la mayoría de los pacientes que presentaban tumores con TMB-H no se beneficiaron del uso del pembrolizumab, y un porcentaje pequeño de pacientes cuyos tumores tenían TMB baja respondieron al tratamiento. Esto indica que aún queda más que aprender para pronosticar quiénes responderán a los medicamentos de inmunoterapia.
Por ejemplo, hay datos que comprueban que la concentración de la TMB necesaria para mejorar la respuesta a la inmunoterapia depende del tipo de cáncer. Saber si la información sobre el tipo de cáncer influye en la respuesta al tratamiento es esencial, porque cualquier tratamiento del cáncer tiene efectos secundarios, incluso económicos (toxicidad financiera).
Esperamos que los estudios más grandes del pembrolizumab, que la FDA requiere como parte de la aprobación acelerada, y otros estudios de investigación financiados por el NIC, ofrezcan respuestas a estas preguntas. Estas respuestas ayudarán luego a los pacientes y a los médicos a conversar y participar en un proceso real, y bien informado, de toma de decisión compartida. Para los pacientes con cáncer avanzado y sus familiares, estas conversaciones son vitales.
En especial durante estos tiempos complejos, a veces uno se vuelve cínico. Pero como he dicho antes, el NCI se compromete a responder a los desafíos de la pandemia de la COVID-19 al mismo tiempo que apoyamos la investigación necesaria para atender las necesidades urgentes de las personas con cáncer y logramos adelantos importantes. La importancia creciente de la función y el valor de la inmunoterapia como tratamiento del cáncer es una buena noticia para los pacientes y es algo que debemos celebrar.

































No hay comentarios:
Publicar un comentario