

Combinación de dabrafenib y trametinib aprobada para melanoma y cáncer de tiroides.
23 de julio de 2018 por Equipo del NCI
La Administración de Alimentos y Medicamentos (FDA) de los EE. UU. aprobó recientemente la combinación de los dos fármacos de acción dirigida, dabrafenib (Tafinlar) y trametinib (Mekinist), para el tratamiento de dos tipos diferentes de cáncer.
La primera aprobación, anunciada el 30 de abril, cubre el uso de la combinación de dos fármacos en algunos pacientes con melanoma avanzado. La segunda aprobación, anunciada el 4 de mayo, cubre a un subgrupo de pacientes con una forma agresiva y poco común de cáncer de tiroides denominado cáncer anaplásico de tiroides. Es la primera vez que se aprueba una terapia específicamente para el tratamiento de cáncer anaplásico de tiroides.
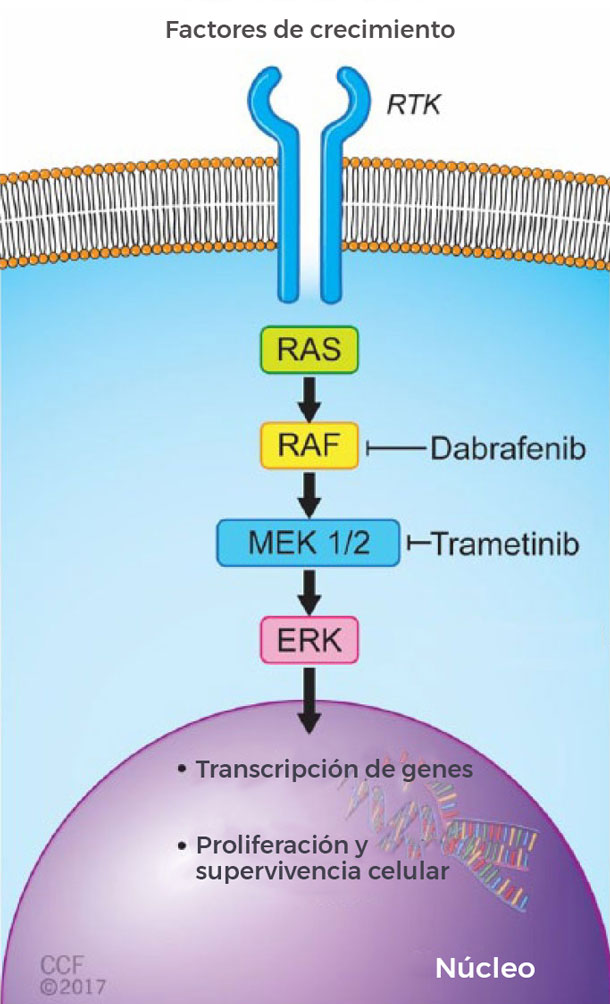
A fin de que los pacientes puedan recibir la combinación de dabrafenib y trametinib para cualquiera de los dos tipos de cáncer, sus tumores deben tener una mutación específica en un gen denominado BRAF. Esta mutación, llamada BRAF V600, puede aumentar el crecimiento y la diseminación de las células cancerosas.
Ambos fármacos tienen un papel específico y bien conocido en la destrucción de tumores, explicó la doctora Larissa Korde del Programa de Evaluación de Terapias del Cáncer del NCI.
"Dabrafenib inhibe la enzima producida por el gen BRAF, que se 'activa' en tumores que albergan mutaciones en el gen. Pero los tumores pueden resistirse a este fármaco activando otras vías de señalización celular", dijo la doctora Korde. "La adición de trametinib bloquea una de estas vías de resistencia y esto conduce a una mejor actividad".
Uso más temprano de la terapia combinada en el tratamiento de melanoma
La FDA había aprobado previamente la combinación de dabrafenib y trametinib para el tratamiento del cáncer de pulmón de células no pequeñas con mutación en el gen BRAF y de melanomas que se habían diseminado a otras partes del cuerpo (metastático) o que no se podían eliminar con cirugía.
La nueva aprobación para el melanoma amplía el uso de la combinación de los fármacos como tratamiento posoperatorio, o adyuvante, en pacientes que tienen células cancerosas en los ganglios linfáticos del área donde se extrajo un tumor por medio de cirugía.
En el estudio clínico en el que se basó la nueva aprobación del tratamiento para el melanoma, que fue financiado por Novartis Pharmaceuticals, casi 60 % de los pacientes que recibieron la combinación de fármacos después de la cirugía permanecieron libres de la enfermedad después de 3 años, en comparación con alrededor de 40 % de quienes recibieron una combinación con placebo.
La combinación también pareció ser más segura que dabrafenib solo (al menos en un aspecto): en comparación con lo que se observó en estudios anteriores de un solo fármaco; en este estudio, de los que recibieron la combinación, hubo un porcentaje menor de pacientes que padecieron un segundo cáncer debido a la terapia.
Los segundos cánceres que se observaron en estudios anteriores de dabrafenib solo quizá fueron impulsados por la misma vía que bloquea trametinib, dijo la doctora Korde. Por lo tanto, al añadir trametinib se podría reducir el riesgo de este efecto secundario, explicó la doctora.
Los efectos secundarios más comunes de la combinación de los dos fármacos son fiebre, cansancio y náuseas.
Una opción de tratamiento significativa para un cáncer poco común
La aprobación para el cáncer anaplásico de tiroides se basó en los resultados de un estudio clínico que inscribió a pacientes con cualquiera de los nueve tipos de cáncer que albergan la mutación V600 en el gen BRAF. De los 23 pacientes con cáncer anaplásico de tiroides inscritos en este estudio, financiado también por Novartis, 57 % presentaron al menos algo de reducción en el tamaño de sus tumores durante el tratamiento, y los tumores desaparecieron por completo en 4% de los pacientes.
Los "estudios en canasta", como el estudio NCI-MATCH, en los que se reclutan pacientes basándose en las características moleculares de sus tumores y no en el lugar del cuerpo donde se presentó el cáncer, están haciéndose cada vez más comunes en la era de los tratamientos dirigidos.
En un artículo publicado en la revista Journal of Clinical Oncology antes de la aprobación de la FDA, los autores del estudio calcularon que 80 % de los pacientes que recibieron dabrafenib y trametinib estarían vivos un año después de comenzar el tratamiento. En comparación, solo 20 a 40 % aproximadamente de los pacientes con cáncer anaplásico de tiroides vivieron un año después del diagnóstico cuando recibieron otras terapias (como radiación o quimioterapia). Los investigadores continuarán el seguimiento de los participantes del estudio para calcular el índice de supervivencia a 1 año y más.
"Un subgrupo considerable de pacientes con cáncer anaplásico de tiroides cuenta ahora con una opción de tratamiento sumamente relevante; para nosotros, esto es un hecho de enorme importancia porque esta enfermedad tiene un pronóstico sombrío", comentó la doctora Barbara Murphy, directora de Oncología de Cabeza y Cuello del Centro Oncológico Vanderbilt-Ingram, quien no participó en el estudio.
Casi un caso de cada cuatro casos de cáncer anaplásico de tiroides porta la mutación V600 en el gen BRAF, dijo la doctora, y las pruebas para esta mutación comenzarán rápidamente a formar parte de la atención convencional de los pacientes con este cáncer.
Un enfoque molecular para el diseño de los estudios
El estudio que llevó a la aprobación del tratamiento para el cáncer anaplásico de tiroides "es realmente un ejemplo extraordinario de cómo estos tumores poco comunes reciben un buen tratamiento cuando se aplica un enfoque racional a la investigación terapéutica" en el que los fármacos se prueban basándose en el conocimiento de las vías moleculares específicas que pueden impulsar el cáncer, dijo la doctora Murphy.
"En el caso de tumores que son infrecuentes, nunca vamos a poder conseguir el número suficiente de pacientes para realizar estudios aleatorizados a gran escala en fase 3. Pero los estudios en canasta son de gran ayuda para pacientes con cánceres poco comunes", agregó la doctora.
La doctora Murphy tiene la esperanza de que a medida que se lleven a cabo más estudios en canasta, los oncólogos de la comunidad estarán cada vez más dispuestos a sugerir esos estudios a sus pacientes con cánceres poco comunes. Estos pacientes han tenido muy pocas oportunidades en el pasado de participar en estudios clínicos, y es importante que los oncólogos remitan a estos pacientes a los hospitales que los realizan, continuó la doctora.
"Los estudios en canasta pueden identificar terapias para los tumores poco comunes, pero los pacientes deben ser derivados a estos estudios para que se puedan acumular esos resultados", dijo la doctora Murphy.
Los resultados de los estudios clínicos en curso quizá respondan también preguntas sobre la acción dirigida al gen BRAF y las vías asociadas en los casos de melanoma, dijo la doctora Korde. Por ejemplo, nivolumab (Opdivo), un tipo de inmunoterapia que se conoce como inhibidor de punto de control inmunitario inhibidor de punto de control inmunitario, recibió la aprobación de la FDA en diciembre de 2017 para usarse como terapia adyuvante para melanomas.
Tanto nivolumab como la combinación de dabrafenib y trametinib son terapias eficaces para el melanoma, continuó la doctora, "[pero] para los pacientes con mutación en el gen BRAF, no sabemos por cuál de estos tratamientos es mejor empezar", dijo la doctora Korde.
Los investigadores están analizando también la posibilidad de iniciar estudios dirigidos a otros mecanismos de resistencia a los fármacos en estos tumores con mutaciones en el BRAF, los que pueden presentarse, aunque se añada trametinib.
"A medida que sepamos más sobre cuáles son las alteraciones genéticas específicas o las características que determinan el crecimiento de los cánceres, probablemente veamos más aprobaciones de fármacos basadas en rasgos moleculares, concluyó la doctora Korde.
































No hay comentarios:
Publicar un comentario