
Facilitar los procedimientos | 01 SEP 20
Muestras de saliva o hisopado nasofaríngeo para SARS-CoV-2
Estudios recientes han demostrado que el SARS-CoV-2 se puede detectar en la saliva de personas asintomáticas y pacientes ambulatorios
Autor/a: Anne L. Wyllie, Ph.D., et al. Fuente: NEJM DOI: 10.1056/NEJMc2016359 Saliva or Nasopharyngeal Swab Specimens for Detection of SARS-CoV-2
Al editor:
Las pruebas de diagnóstico rápidas y precisas son esenciales para controlar la pandemia de Covid-19 en curso. Aunque el estándar actual implica la prueba de muestras de hisopos nasofaríngeos mediante la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (RT-qPCR) para detectar el SARS-CoV-2, las muestras de saliva pueden ser una muestra de diagnóstico alternativa.
Se necesita una evaluación rigurosa para determinar cómo Las muestras de saliva se comparan con las muestras de hisopos nasofaríngeos con respecto a la sensibilidad en la detección del SARS-CoV-2 durante el curso de la infección.
Un total de 70 pacientes hospitalizados con Covid-19 proporcionaron su consentimiento informado por escrito para participar en nuestro estudio. Después de que se confirmó Covid-19 con una muestra de hisopado nasofaríngeo positivo en el momento de la admisión al hospital, obtuvimos muestras adicionales de los pacientes durante la hospitalización.
Probamos muestras de saliva recolectadas por los propios pacientes y frotis nasofaríngeos recolectados de los pacientes en el mismo momento por los trabajadores de la salud.
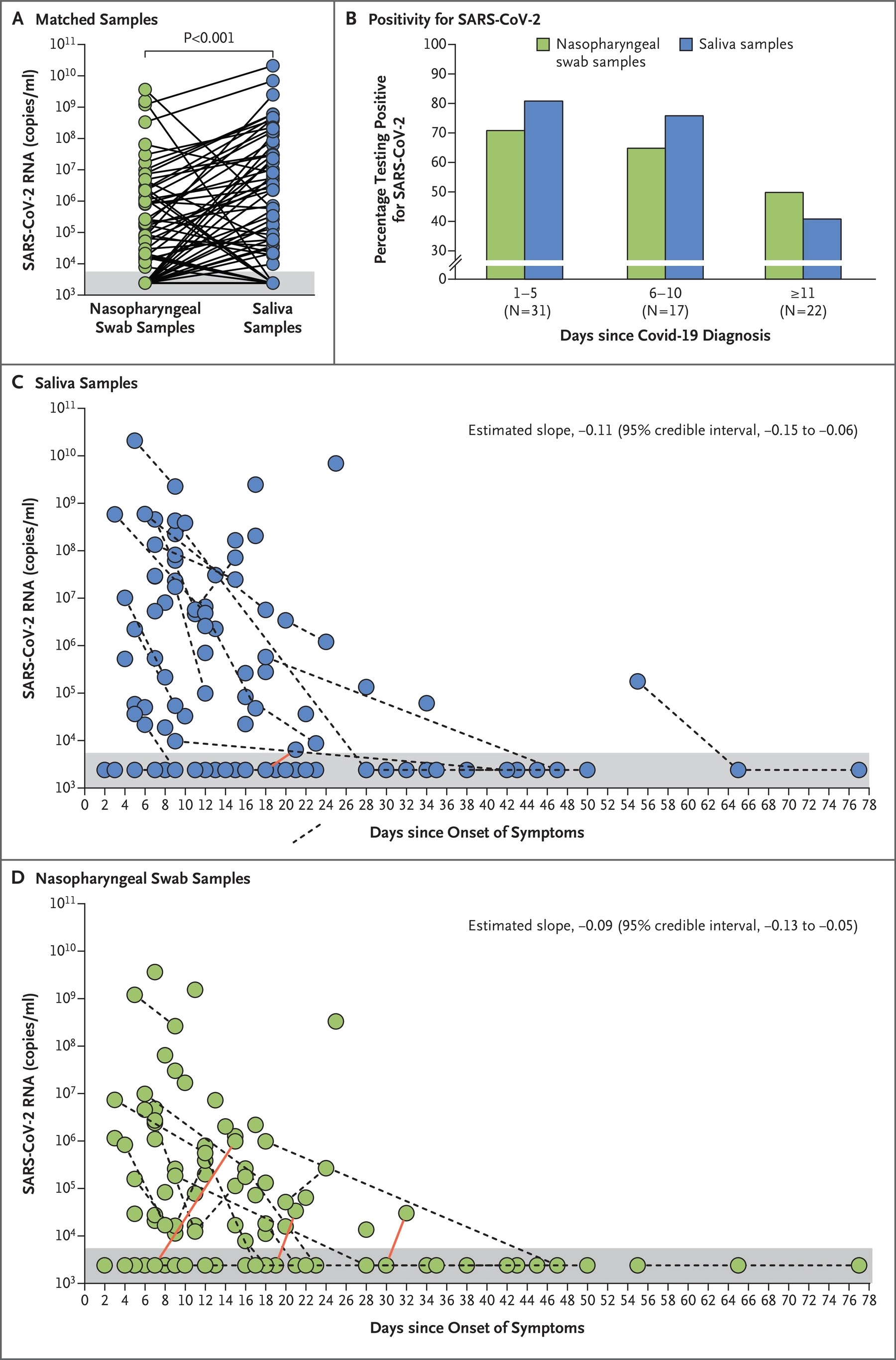
Figura 1. Títulos de ARN del SARS-CoV-2 en muestras de saliva y muestras de torunda nasofaríngea.Utilizando secuencias de cebadores de los Centros para el Control y la Prevención de Enfermedades, detectamos más copias de ARN del SARS-CoV-2 en las muestras de saliva (logaritmo de copias promedio por mililitro, 5,58; intervalo de confianza [IC] del 95%, 5,09 a 6,07) que en el muestras de hisopado nasofaríngeo (media de copias logarítmicas por mililitro, 4,93; IC del 95%, 4,53 a 5,33) (Figura 1A y Figura S1 en el Apéndice complementario 1).
Además, un mayor porcentaje de muestras de saliva que las muestras de hisopos nasofaríngeos fueron positivas hasta 10 días después del diagnóstico de Covid-19 (Figura 1B).
De 1 a 5 días después del diagnóstico, el 81% (IC del 95%, 71 a 96) de las muestras de saliva fueron positivas, en comparación con el 71% (IC del 95%, 67 a 94) de las muestras de hisopado nasofaríngeo.
Estos hallazgos sugieren que las muestras de saliva y las muestras de frotis nasofaríngeos tienen al menos una sensibilidad similar en la detección del SARS-CoV-2 durante el curso de la hospitalización.
Debido a que los resultados de las pruebas de muestras de hisopos nasofaríngeos para detectar el SARS-CoV-2 pueden variar con el muestreo repetido en pacientes individuales, 5 evaluamos la detección viral en muestras emparejadas a lo largo del tiempo.
El nivel de ARN del SARS-CoV-2 disminuyó después de la aparición de los síntomas en ambas muestras de saliva (pendiente estimada, −0,11; intervalo creíble del 95%, −0,15 a −0,06) (Figura 1C) y muestras de hisopado nasofaríngeo (pendiente estimada, −0,09; Intervalo de credibilidad del 95%, −0,13 a −0,05) (Figura 1D).
En tres casos, una muestra de torunda nasofaríngea negativa fue seguida de una torunda positiva en la siguiente recolección de una muestra (Figura 1D); este fenómeno ocurrió solo una vez con las muestras de saliva (Figura 1C).
Durante el curso clínico, observamos menos variación en los niveles de ARN del SARS-CoV-2 en las muestras de saliva (desviación estándar, 0,98 copias de ARN del virus por mililitro; intervalo creíble del 95%, 0,08 a 1,98) que en las muestras de hisopado nasofaríngeo (estándar desviación, 2,01 copias de ARN del virus por mililitro; intervalo de credibilidad del 95%, 1,29 a 2,70) (véase el Apéndice complementario 1).
Detectamos ARN del SARS-CoV-2 en muestras de saliva obtenidas de 13 personas que no informaron ningún síntoma en el momento de la recolección de la muestra o antes. De estos 13 trabajadores de la salud, 9 habían recolectado muestras de frotis nasofaríngeos coincidentes por sí mismas el mismo día, y 7 de estas muestras dieron negativo (Fig. S2).
El diagnóstico en los 13 trabajadores de la salud con muestras de saliva positivas se confirmó posteriormente en pruebas de diagnóstico de muestras nasofaríngeas adicionales por un laboratorio certificado por CLIA (Clinical Laboratory Improvement Enmiendas de 1988).
La variación en el muestreo nasofaríngeo puede ser una explicación de los resultados falsos negativos, por lo que el monitoreo de un control interno para la recolección adecuada de muestras puede proporcionar una evaluación técnica alternativa.
En las muestras recolectadas de pacientes hospitalizados por los trabajadores de la salud, encontramos una mayor variación en los valores del umbral del ciclo de la RNasa P humana (Ct) en las muestras de hisopado nasofaríngeo (desviación estándar, 2,89 Ct; IC del 95%, 26,53 a 27,69) que en las muestras de saliva (desviación estándar , 2,49 Ct; IC del 95%, 23,35 a 24,35).
Cuando los trabajadores de la salud recolectaron sus propias muestras, también encontramos una mayor variación en los valores de RNasa P Ct en las muestras de torunda nasofaríngea (desviación estándar, 2.26 Ct; IC del 95%, 28.39 a 28.56) que en las muestras de saliva (desviación estándar, 1.65 Ct; 95 % IC, 24,14 a 24,26) (Fig. S3).
La recolección de muestras de saliva por parte de los propios pacientes niega la necesidad de interacción directa entre los trabajadores de la salud y los pacientes. Esta interacción es una fuente de importantes cuellos de botella en las pruebas y presenta un riesgo de infección nosocomial. La recolección de muestras de saliva por parte de los propios pacientes también alivia la demanda de suministros de hisopos y equipo de protección personal. Dada la creciente necesidad de realizar pruebas, nuestros hallazgos respaldan el potencial de las muestras de saliva en el diagnóstico de la infección por SARS-CoV-2.
Las pruebas de diagnóstico rápidas y precisas son esenciales para controlar la pandemia de Covid-19 en curso. Aunque el estándar actual implica la prueba de muestras de hisopos nasofaríngeos mediante la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (RT-qPCR) para detectar el SARS-CoV-2, las muestras de saliva pueden ser una muestra de diagnóstico alternativa.
Se necesita una evaluación rigurosa para determinar cómo Las muestras de saliva se comparan con las muestras de hisopos nasofaríngeos con respecto a la sensibilidad en la detección del SARS-CoV-2 durante el curso de la infección.
Un total de 70 pacientes hospitalizados con Covid-19 proporcionaron su consentimiento informado por escrito para participar en nuestro estudio. Después de que se confirmó Covid-19 con una muestra de hisopado nasofaríngeo positivo en el momento de la admisión al hospital, obtuvimos muestras adicionales de los pacientes durante la hospitalización.
Probamos muestras de saliva recolectadas por los propios pacientes y frotis nasofaríngeos recolectados de los pacientes en el mismo momento por los trabajadores de la salud.

Figura 1. Títulos de ARN del SARS-CoV-2 en muestras de saliva y muestras de torunda nasofaríngea.
Además, un mayor porcentaje de muestras de saliva que las muestras de hisopos nasofaríngeos fueron positivas hasta 10 días después del diagnóstico de Covid-19 (Figura 1B).
De 1 a 5 días después del diagnóstico, el 81% (IC del 95%, 71 a 96) de las muestras de saliva fueron positivas, en comparación con el 71% (IC del 95%, 67 a 94) de las muestras de hisopado nasofaríngeo.
Estos hallazgos sugieren que las muestras de saliva y las muestras de frotis nasofaríngeos tienen al menos una sensibilidad similar en la detección del SARS-CoV-2 durante el curso de la hospitalización.
Debido a que los resultados de las pruebas de muestras de hisopos nasofaríngeos para detectar el SARS-CoV-2 pueden variar con el muestreo repetido en pacientes individuales, 5 evaluamos la detección viral en muestras emparejadas a lo largo del tiempo.
El nivel de ARN del SARS-CoV-2 disminuyó después de la aparición de los síntomas en ambas muestras de saliva (pendiente estimada, −0,11; intervalo creíble del 95%, −0,15 a −0,06) (Figura 1C) y muestras de hisopado nasofaríngeo (pendiente estimada, −0,09; Intervalo de credibilidad del 95%, −0,13 a −0,05) (Figura 1D).
En tres casos, una muestra de torunda nasofaríngea negativa fue seguida de una torunda positiva en la siguiente recolección de una muestra (Figura 1D); este fenómeno ocurrió solo una vez con las muestras de saliva (Figura 1C).
Durante el curso clínico, observamos menos variación en los niveles de ARN del SARS-CoV-2 en las muestras de saliva (desviación estándar, 0,98 copias de ARN del virus por mililitro; intervalo creíble del 95%, 0,08 a 1,98) que en las muestras de hisopado nasofaríngeo (estándar desviación, 2,01 copias de ARN del virus por mililitro; intervalo de credibilidad del 95%, 1,29 a 2,70) (véase el Apéndice complementario 1).
Estudios recientes han demostrado que el SARS-CoV-2 se puede detectar en la saliva de personas asintomáticas y pacientes ambulatorios.Por lo tanto, seleccionamos a 495 trabajadores de la salud asintomáticos que dieron su consentimiento informado por escrito para participar en nuestro estudio prospectivo, y utilizamos RT- qPCR para analizar muestras de saliva y nasofaríngeas obtenidas de estas personas.
Detectamos ARN del SARS-CoV-2 en muestras de saliva obtenidas de 13 personas que no informaron ningún síntoma en el momento de la recolección de la muestra o antes. De estos 13 trabajadores de la salud, 9 habían recolectado muestras de frotis nasofaríngeos coincidentes por sí mismas el mismo día, y 7 de estas muestras dieron negativo (Fig. S2).
El diagnóstico en los 13 trabajadores de la salud con muestras de saliva positivas se confirmó posteriormente en pruebas de diagnóstico de muestras nasofaríngeas adicionales por un laboratorio certificado por CLIA (Clinical Laboratory Improvement Enmiendas de 1988).
La variación en el muestreo nasofaríngeo puede ser una explicación de los resultados falsos negativos, por lo que el monitoreo de un control interno para la recolección adecuada de muestras puede proporcionar una evaluación técnica alternativa.
En las muestras recolectadas de pacientes hospitalizados por los trabajadores de la salud, encontramos una mayor variación en los valores del umbral del ciclo de la RNasa P humana (Ct) en las muestras de hisopado nasofaríngeo (desviación estándar, 2,89 Ct; IC del 95%, 26,53 a 27,69) que en las muestras de saliva (desviación estándar , 2,49 Ct; IC del 95%, 23,35 a 24,35).
Cuando los trabajadores de la salud recolectaron sus propias muestras, también encontramos una mayor variación en los valores de RNasa P Ct en las muestras de torunda nasofaríngea (desviación estándar, 2.26 Ct; IC del 95%, 28.39 a 28.56) que en las muestras de saliva (desviación estándar, 1.65 Ct; 95 % IC, 24,14 a 24,26) (Fig. S3).
La recolección de muestras de saliva por parte de los propios pacientes niega la necesidad de interacción directa entre los trabajadores de la salud y los pacientes. Esta interacción es una fuente de importantes cuellos de botella en las pruebas y presenta un riesgo de infección nosocomial. La recolección de muestras de saliva por parte de los propios pacientes también alivia la demanda de suministros de hisopos y equipo de protección personal. Dada la creciente necesidad de realizar pruebas, nuestros hallazgos respaldan el potencial de las muestras de saliva en el diagnóstico de la infección por SARS-CoV-2.
































No hay comentarios:
Publicar un comentario