
Buen perfil de seguridad y fuerte respuesta inmune | 07 SEP 20
Primeros ensayos clínicos de la vacuna rusa COVID-19
Seguridad e inmunogenicidad de una vacuna COVID-19 heteróloga prime-boost basada en vectores rAd26 y rAd5 en dos formulaciones: dos estudios abiertos de fase 1/2 no aleatorizados de Rusia

Autor/a: Denis Y Logunov, DS, V Dolzhikova, PhD, et al. Fuente: The Lancet DOI:https://doi.org/10.1016/S0140-6736(20)31866-3 Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia
Resumen
Antecedentes
Desarrollamos una vacuna COVID-19 heteróloga que consta de dos componentes, un vector de adenovirus recombinante tipo 26 (rAd26) y un vector de adenovirus recombinante tipo 5 (rAd5), ambos portadores del gen del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2). ) glicoproteína de pico (rAd26-S y rAd5-S).
Nuestro objetivo fue evaluar la seguridad e inmunogenicidad de dos formulaciones (congelada y liofilizada) de esta vacuna.
Métodos
Hicimos dos estudios de fase 1/2 abiertos, no aleatorios, en dos hospitales de Rusia. Inscribimos a voluntarios adultos sanos (hombres y mujeres) de entre 18 y 60 años en ambos estudios.
En la fase 1 de cada estudio, administramos por vía intramuscular el día 0 una dosis de rAd26-S o una dosis de rAd5-S y evaluamos la seguridad de los dos componentes durante 28 días.
En la fase 2 del estudio, que comenzó no antes de 5 días después de la vacunación de la fase 1, administramos por vía intramuscular una vacuna de refuerzo primario, con rAd26-S administrado el día 0 y rAd5-S el día 21.
Las medidas de resultado primarias fueron el antígeno- inmunidad humoral específica (anticuerpos específicos del SARS-CoV-2 medidos por ELISA los días 0, 14, 21, 28 y 42) y seguridad (número de participantes con eventos adversos monitoreados durante todo el estudio).
Las medidas de resultado secundarias fueron la inmunidad celular específica de antígeno (respuestas de células T y concentración de interferón-γ) y el cambio en los anticuerpos neutralizantes (detectado con un ensayo de neutralización del SARS-CoV-2).
Estos ensayos están registrados en ClinicalTrials.gov, NCT04436471 y NCT04437875.
Resultados
Entre el 18 de junio y el 3 de agosto de 2020, inscribimos a 76 participantes en los dos estudios (38 en cada estudio). En cada estudio, nueve voluntarios recibieron rAd26-S en la fase 1, nueve recibieron rAd5-S en la fase 1 y 20 recibieron rAd26-S y rAd5-S en la fase 2.
Todos los participantes produjeron anticuerpos contra la glicoproteína SARS-CoV-2. El día 42, los títulos de IgG específicos del dominio de unión al receptor fueron 14703 con la formulación congelada y 11143 con la formulación liofilizada, y los anticuerpos neutralizantes fueron 49.25 con la formulación congelada y 45.95 con la formulación liofilizada, con una tasa de seroconversión del 100%.
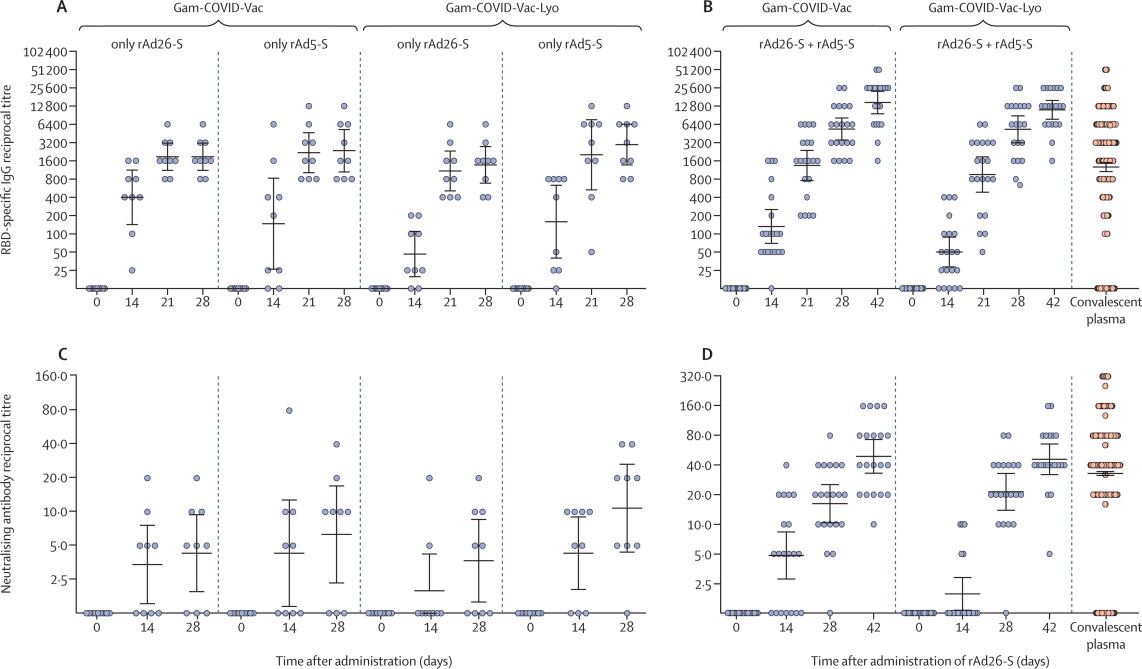
Respuesta de inmunidad humoralSe detectaron respuestas mediadas por células en todos los participantes el día 28, con una mediana de proliferación celular de 2 · 5% CD4 + y 13% CD8 + con la formulación congelada, y una mediana de proliferación celular de 13% CD4 + y 1 · 1% CD8 + con la formulación liofilizada.
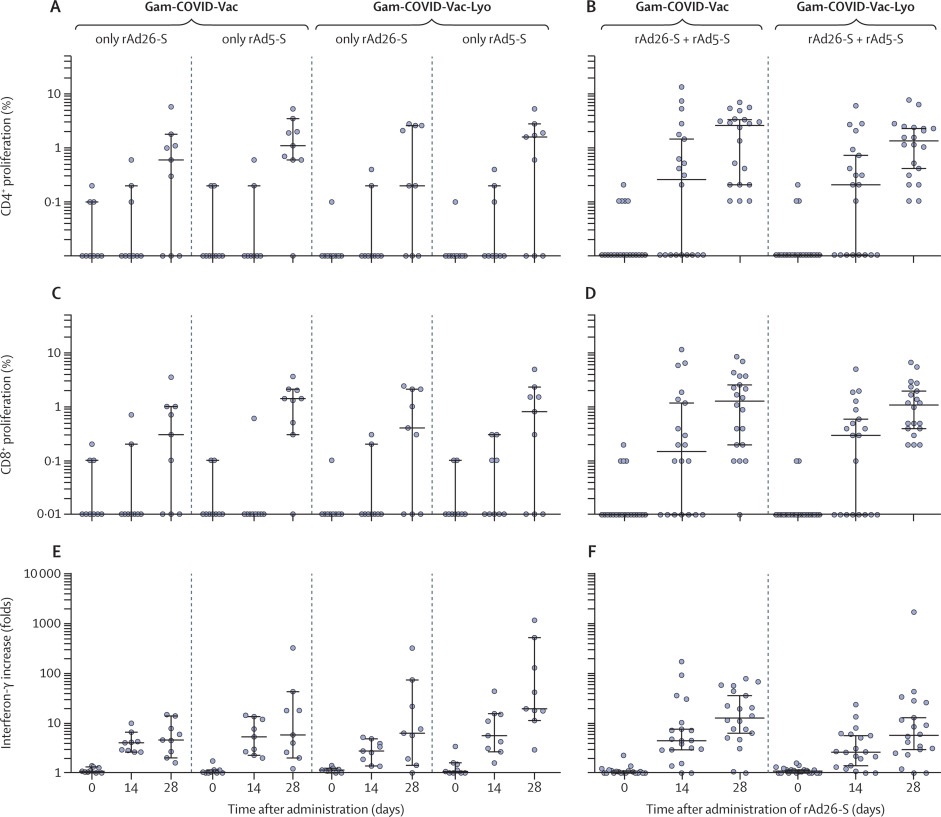
Respuesta de inmunidad celular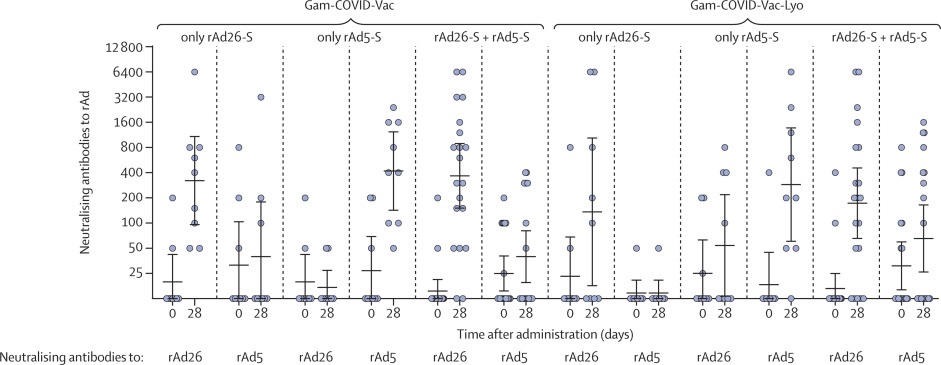
Respuesta de anticuerpos neutralizantes a los vectores rAd26 y rAd5 después de la inmunización
Investigación en contexto
Evidencia antes de este estudio
Se realizaron búsquedas en ClinicalTrials.gov y PubMed hasta el 13 de agosto de 2020, con los términos "COVID-19" O "SARS-CoV-2" Y "vacuna" Y "ensayo clínico", sin restricciones de fecha o idioma, para encontrar información. sobre las candidatas a vacunas COVID-19 basadas en adenovirus en ensayos clínicos activos. Según la OMS, el 13 de agosto de 2020, se estaban probando 29 vacunas candidatas basadas en diferentes plataformas (vectorizadas, ADN, ARNm, inactivadas, etc.) en ensayos clínicos contra las proteínas del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2).
Las vacunas basadas en vectores virales recombinantes son candidatos prometedores para la prevención de COVID-19 porque inducen respuestas inmunitarias humorales y celulares y pueden proporcionar inmunidad protectora después de una o dos dosis.
Se han probado varias vacunas COVID-19 candidatas en ensayos clínicos, incluida una vacuna basada en vectores de adenovirus tipo 5 (Ad5) (CanSino Biological / Instituto de Biotecnología de Beijing, China), una vacuna basada en vectores Ad26 (Johnson & Johnson, EE. UU.) y una vacuna que contiene un vector adenoviral de simio (AstraZeneca / Universidad de Oxford, Reino Unido).
Dado que la vacunación de refuerzo es necesaria para la formación de una respuesta inmune más poderosa, la efectividad de dicha vacunación puede reducirse cuando se usa un vector homólogo (debido a la formación de una respuesta inmune no solo al antígeno diana sino también a los componentes del vector después de la vacunación inicial ).
Valor agregado de este estudio
Diseñamos una vacuna COVID-19 con dos vectores adenovirales diferentes (Ad26 recombinante [rAd26] y Ad5 recombinante [rAd5]), ambos portadores del gen de la glicoproteína pico del SARS-CoV-2 (rAd26-S y rAd5-S), y se implementó un régimen de refuerzo inicial. Hicimos dos ensayos abiertos no aleatorizados de fase 1/2 de dos formulaciones (congeladas y liofilizadas) de la vacuna en voluntarios adultos sanos.
La seguridad de los dos componentes individuales de la vacuna (rAd26-S y rAd5-S) se confirmó en la fase 1. Luego, ambos componentes se administraron como una vacuna de refuerzo primario en la fase 2, con pruebas de seguridad e inmunogenicidad.
Los anticuerpos contra la glicoproteína del SARS-CoV-2 y los anticuerpos neutralizantes aumentaron significativamente el día 14 y continuaron aumentando durante todo el período de observación.
Las respuestas específicas de las células T alcanzaron su punto máximo el día 28 después de la vacunación.
Implicaciones de toda la evidencia disponible
Nuestros hallazgos indican que una vacuna COVID-19 heteróloga basada en vectores rAd26 y rAd5 es segura e inmunogénica en adultos sanos. Se necesita más investigación sobre la efectividad de esta vacuna para la prevención de COVID-19.
En conclusión, estos datos muestran colectivamente que la vacuna heteróloga basada en rAd26-S y rAd5-S es segura, bien tolerada y no causa eventos adversos graves en voluntarios adultos sanos.
La vacuna es altamente inmunogénica e induce fuertes respuestas inmunitarias humorales y celulares en el 100% de los voluntarios adultos sanos, con títulos de anticuerpos en los participantes vacunados más altos que en los del plasma convaleciente.
Se han tomado medidas sin precedentes para desarrollar una vacuna COVID-19 en Rusia. Basándonos en nuestra propia experiencia en el desarrollo de vacunas contra la enfermedad por el virus del Ébola y MERS, la vacuna COVID-19 se ha desarrollado en poco tiempo. Se han realizado estudios preclínicos y clínicos que han permitido aprobar provisionalmente la vacuna bajo el actual Decreto del Gobierno de la Federación de Rusia de 3 de abril de 2020, no 441 de 11 de agosto de 2020 (registro no LP-006395 [Gam -COVID-Vac]) y el 26 de agosto de 2020 (registro no LP-006423 [Gam-COVID-Vac-Lyo]).
La licencia provisional requiere un estudio a gran escala, permite la vacunación en una población general autorizada en el contexto de un ensayo de fase 3, permite que la vacuna se ponga en uso en una población bajo estricta farmacovigilancia y proporciona la vacunación de grupos de riesgo.
El ensayo clínico de fase 3 fue aprobado por las autoridades competentes nacionales y locales correspondientes, incluido el regulador (Departamento de Regulación Estatal para la Distribución de Medicamentos) y el comité de ética del Ministerio de Salud de la Federación de Rusia, el 26 de agosto de 2020 (aprobación 450 ).
Fondos: Ministerio de Salud de la Federación de Rusia.
Antecedentes
Desarrollamos una vacuna COVID-19 heteróloga que consta de dos componentes, un vector de adenovirus recombinante tipo 26 (rAd26) y un vector de adenovirus recombinante tipo 5 (rAd5), ambos portadores del gen del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2). ) glicoproteína de pico (rAd26-S y rAd5-S).
Nuestro objetivo fue evaluar la seguridad e inmunogenicidad de dos formulaciones (congelada y liofilizada) de esta vacuna.
Métodos
Hicimos dos estudios de fase 1/2 abiertos, no aleatorios, en dos hospitales de Rusia. Inscribimos a voluntarios adultos sanos (hombres y mujeres) de entre 18 y 60 años en ambos estudios.
En la fase 1 de cada estudio, administramos por vía intramuscular el día 0 una dosis de rAd26-S o una dosis de rAd5-S y evaluamos la seguridad de los dos componentes durante 28 días.
En la fase 2 del estudio, que comenzó no antes de 5 días después de la vacunación de la fase 1, administramos por vía intramuscular una vacuna de refuerzo primario, con rAd26-S administrado el día 0 y rAd5-S el día 21.
Las medidas de resultado primarias fueron el antígeno- inmunidad humoral específica (anticuerpos específicos del SARS-CoV-2 medidos por ELISA los días 0, 14, 21, 28 y 42) y seguridad (número de participantes con eventos adversos monitoreados durante todo el estudio).
Las medidas de resultado secundarias fueron la inmunidad celular específica de antígeno (respuestas de células T y concentración de interferón-γ) y el cambio en los anticuerpos neutralizantes (detectado con un ensayo de neutralización del SARS-CoV-2).
Estos ensayos están registrados en ClinicalTrials.gov, NCT04436471 y NCT04437875.
Resultados
Entre el 18 de junio y el 3 de agosto de 2020, inscribimos a 76 participantes en los dos estudios (38 en cada estudio). En cada estudio, nueve voluntarios recibieron rAd26-S en la fase 1, nueve recibieron rAd5-S en la fase 1 y 20 recibieron rAd26-S y rAd5-S en la fase 2.
Ambas formulaciones de vacunas fueron seguras y bien toleradas.Los eventos adversos más comunes fueron dolor en el lugar de la inyección (44 [58%]), hipertermia (38 [50%]), dolor de cabeza (32 [42%]), astenia (21 [28%]) y dolor muscular y articular. (18 [24%]). La mayoría de los eventos adversos fueron leves y no se detectaron eventos adversos graves.
Todos los participantes produjeron anticuerpos contra la glicoproteína SARS-CoV-2. El día 42, los títulos de IgG específicos del dominio de unión al receptor fueron 14703 con la formulación congelada y 11143 con la formulación liofilizada, y los anticuerpos neutralizantes fueron 49.25 con la formulación congelada y 45.95 con la formulación liofilizada, con una tasa de seroconversión del 100%.

Respuesta de inmunidad humoral

Respuesta de inmunidad celular

Respuesta de anticuerpos neutralizantes a los vectores rAd26 y rAd5 después de la inmunización
Interpretación
|
Evidencia antes de este estudio
Se realizaron búsquedas en ClinicalTrials.gov y PubMed hasta el 13 de agosto de 2020, con los términos "COVID-19" O "SARS-CoV-2" Y "vacuna" Y "ensayo clínico", sin restricciones de fecha o idioma, para encontrar información. sobre las candidatas a vacunas COVID-19 basadas en adenovirus en ensayos clínicos activos. Según la OMS, el 13 de agosto de 2020, se estaban probando 29 vacunas candidatas basadas en diferentes plataformas (vectorizadas, ADN, ARNm, inactivadas, etc.) en ensayos clínicos contra las proteínas del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2).
Las vacunas basadas en vectores virales recombinantes son candidatos prometedores para la prevención de COVID-19 porque inducen respuestas inmunitarias humorales y celulares y pueden proporcionar inmunidad protectora después de una o dos dosis.
Se han probado varias vacunas COVID-19 candidatas en ensayos clínicos, incluida una vacuna basada en vectores de adenovirus tipo 5 (Ad5) (CanSino Biological / Instituto de Biotecnología de Beijing, China), una vacuna basada en vectores Ad26 (Johnson & Johnson, EE. UU.) y una vacuna que contiene un vector adenoviral de simio (AstraZeneca / Universidad de Oxford, Reino Unido).
Dado que la vacunación de refuerzo es necesaria para la formación de una respuesta inmune más poderosa, la efectividad de dicha vacunación puede reducirse cuando se usa un vector homólogo (debido a la formación de una respuesta inmune no solo al antígeno diana sino también a los componentes del vector después de la vacunación inicial ).
Valor agregado de este estudio
Diseñamos una vacuna COVID-19 con dos vectores adenovirales diferentes (Ad26 recombinante [rAd26] y Ad5 recombinante [rAd5]), ambos portadores del gen de la glicoproteína pico del SARS-CoV-2 (rAd26-S y rAd5-S), y se implementó un régimen de refuerzo inicial. Hicimos dos ensayos abiertos no aleatorizados de fase 1/2 de dos formulaciones (congeladas y liofilizadas) de la vacuna en voluntarios adultos sanos.
La seguridad de los dos componentes individuales de la vacuna (rAd26-S y rAd5-S) se confirmó en la fase 1. Luego, ambos componentes se administraron como una vacuna de refuerzo primario en la fase 2, con pruebas de seguridad e inmunogenicidad.
La vacuna fue bien tolerada y produjo respuestas inmunitarias humorales y celulares en adultos sanos.Se obtuvieron respuestas de IgG en todos los participantes, con títulos medios geométricos significativamente más altos que los informados en personas que se han recuperado del COVID-19.
Los anticuerpos contra la glicoproteína del SARS-CoV-2 y los anticuerpos neutralizantes aumentaron significativamente el día 14 y continuaron aumentando durante todo el período de observación.
Las respuestas específicas de las células T alcanzaron su punto máximo el día 28 después de la vacunación.
Implicaciones de toda la evidencia disponible
Nuestros hallazgos indican que una vacuna COVID-19 heteróloga basada en vectores rAd26 y rAd5 es segura e inmunogénica en adultos sanos. Se necesita más investigación sobre la efectividad de esta vacuna para la prevención de COVID-19.
En conclusión, estos datos muestran colectivamente que la vacuna heteróloga basada en rAd26-S y rAd5-S es segura, bien tolerada y no causa eventos adversos graves en voluntarios adultos sanos.
La vacuna es altamente inmunogénica e induce fuertes respuestas inmunitarias humorales y celulares en el 100% de los voluntarios adultos sanos, con títulos de anticuerpos en los participantes vacunados más altos que en los del plasma convaleciente.
Se han tomado medidas sin precedentes para desarrollar una vacuna COVID-19 en Rusia. Basándonos en nuestra propia experiencia en el desarrollo de vacunas contra la enfermedad por el virus del Ébola y MERS, la vacuna COVID-19 se ha desarrollado en poco tiempo. Se han realizado estudios preclínicos y clínicos que han permitido aprobar provisionalmente la vacuna bajo el actual Decreto del Gobierno de la Federación de Rusia de 3 de abril de 2020, no 441 de 11 de agosto de 2020 (registro no LP-006395 [Gam -COVID-Vac]) y el 26 de agosto de 2020 (registro no LP-006423 [Gam-COVID-Vac-Lyo]).
La licencia provisional requiere un estudio a gran escala, permite la vacunación en una población general autorizada en el contexto de un ensayo de fase 3, permite que la vacuna se ponga en uso en una población bajo estricta farmacovigilancia y proporciona la vacunación de grupos de riesgo.
El ensayo clínico de fase 3 fue aprobado por las autoridades competentes nacionales y locales correspondientes, incluido el regulador (Departamento de Regulación Estatal para la Distribución de Medicamentos) y el comité de ética del Ministerio de Salud de la Federación de Rusia, el 26 de agosto de 2020 (aprobación 450 ).
El ensayo clínico de fase 3 está previsto con la participación de 40.000 voluntarios de diferentes edades y grupos de riesgo.El ensayo clínico de fase 3 se realizará con un seguimiento constante del estado de los voluntarios a través de una aplicación online, y cada dosis de vacuna tendrá su propio código QR, que será asignado al voluntario.
Fondos: Ministerio de Salud de la Federación de Rusia.
































No hay comentarios:
Publicar un comentario