
Pautas de la Cleveland Clinic | 07 SEP 20
Coagulopatía asociada a COVID-19
La coagulopatía asociada al COVID-19 (CAC) y la coagulación intravascular diseminada son especialmente comunes y se asocian con enfermedad grave y muerte.
Autor/a: Simon R. Mucha, iddharth Dugar, Keith McCra et. al. Cleveland Clinic Journal of Medicine Vol 87 - N°8 August 2020
Texto principal
| Un estado altamente trombótico |
Otros escenarios de alto riesgo son, la necesidad de circuitos de diálisis y el reemplazo del catéter, pues implican la interrupción frecuente del tratamiento de reemplazo renal continuo.
Dos estudios recientes apoyan la impresión clínica de que COVID-19 es muy trombótico.
- Cui et al informaron una incidencia del 25% de trombosis venosa profunda en pacientes con neumonía grave por coronavirus.
- Klok et al hallaron una incidencia combinada del 31%, de trombosis venosa profunda, embolia combinada y trombosis arterial, en pacientes con coronavirus en estado crítico. De estos eventos, el 81% fueron tromboembolias pulmonares.
Otro hallazgo frecuente es el "flujo venoso lento". Este patrón, descrito como ecogenicidad amorfa en las venas principales, se ha asociado con mayor riesgo posterior de trombosis venosa profunda.
| Resultados de laboratorio: dímero D elevado |
El tiempo de protrombina y el tiempo parcial de tromboplastina activado solo se prolongan un poco, y los recuentos de las plaquetas suelen ser normales o levemente bajos.
Los niveles elevados del dímero D en la presentación del COVID-19 están asociados con mayor severidad de la enfermedad.En el 59,6 %% de los pacientes con enfermedad grave se hallaron niveles ≥0,5 μg/ml mientras que en los pacientes con enfermedad leve, los niveles fueron del 43,2%. Los niveles elevados también se correlacionaron con la necesidad de cuidados intensivos y muerte.
En un análisis de regresión multivariable de 191 pacientes, Zhou et al informaron que el riesgo de muerte fue más de 18 veces mayor en los pacientes internados con un nivel de dímero D >1 μg/ ml vs. un nivel <0,5 μg/ml.
Cui et al informaron que los niveles del dímero D también se correlacionaron con el riesgo de tromboembolismo: un nivel de 3,0 μg/ml tuvo una sensibilidad del 70%, con una especificidad del 96,7% y un valor predictivo positivo del 87,5%.
Maatman et al informaron que la profilaxis estándar contra la tromboembolia venosa falló en 29 de 109 pacientes en la unidad de cuidados intensivos, y en quienes falló, el dímero D tenía niveles >3,0 μg/ml.
> Otras medidas predictivas de coagulopatía
En la infección por COVID-19 también se han estudiado otros indicadores de coagulopatía y se halló una asociación con un riesgo mayor.
• Tiempo de protrombina, tiempo parcial de tromboplastina activada. Klok et al no informaron los niveles del dímero D, pero identificaron la coagulopatía (prolongación del tiempo de protrombina de >3 segundos o tiempo de tromboplastina activada >5 segundos) como un factor de riesgo independiente de trombosis.
• Anticuerpos antifosfolípidos. Zhang et al informaron que 3 pacientes con CAC e isquemia de las extremidades inferiores tenían anticuerpos antifosfolípidos (IgA, anticardiolipina, glucoproteína 1 anti-ß-2 IgA e IgG) pero no anticoagulante lúpico.
En un estudio multicéntrico de 150 pacientes con COVID-19 de unidades de cuidados intensivos en Francia, Helms et al hallaron una tasa notablemente elevada de positividad para Helms et al anticoagulante lúpico: 50 de 57 pacientes (87,7%) que tenían un tiempo de tromboplastina parcial activada elevado.
• Puntaje de coagulación intravascular diseminada. Tang et al hallaron que la progresión de la coagulopatía a la coagulación intravascular diseminada manifiesta (≥ 5 puntos según la definición de la International Society on Thrombosis and Haemostasis) predijo un mal pronóstico, que ocurre en el 71,4% de todos los que no han sobrevivido vs. 0,6% de los supervivientes.
• Coagulopatía de consumo progresiva. La disminución de los niveles de antitrombina III, el aumento del tiempo de protrombina y del tiempo parcial de trombolastina activada y, un marcado aumento adicional del dímero D (>15,0 μg/ml) parecen indicar una enfermedad grave y progresiva, que se desarrolla tarde en el curso de la enfermedad (en los días 10 a 14) de los que no suprevivieron.
Los niveles de fibrinógeno, que son elevados en la fase inicial, caen tardíamente en el curso de la enfermedad en los que no sobreviven y puede indicar la muerte inminente.Plaquetopenia. En un metaanálisis de 9 estudios con 1.779 pacientes con COVID-19, Lippi et al examinaron la trombocitopenia como un marcador de la gravedad de la enfermedad. La trombocitopenia en el momento de la presentación se asoció con mayor riesgo de enfermedad grave y muerte. Los autores notaron una gran heterogeneidad entre los estudios, con informes de tasas de trombocitopenia en enfermedades graves que oscilan entre el 4% y el 57,7%.
| Daño pulmonar severo por inflamación y trombosis |
Una serie de autopsias de 11 pacientes mostró trombosis de pequeños vasos y arterias pulmonares de tamaño medio en todos los pacientes. También se informó lesión de las células endoteliales y trombosis microvascular difusa en órganos extrapulmonares, sugestivas de trombosis microangiopática, lo que puede explicar el inicio agudo de la insuficiencia multiorgánica sin una etiología por lo demás obvia.
| Fisiopatología: la inflamación promueve la trombosis |
El sello distintivo del COVID-19 es la inflamación profunda, descrita como "tormenta de citocinas", caracterizada por niveles elevados de IL-1, IL-6, factor de necrosis tumoral y otras citocinas inflamatorias.La inflamación promueve la trombosis a través de diversos mecanismos: activación de células endoteliales, plaquetas, monocitos y tejidos, vía factor VIIa y, alteración de la fibrinólisis y de las vías anticoagulantes naturales (por. ej., a través de cambios en los niveles de trombomodulina, proteínas C y S e inhibidor de la vía del factor tisular).
En el SARS de otras etiologías también se ha visto inflamación intensa con trombosis de los vasos pulmonares. Queda por ver si estos hallazgos representan un fenotipo distinto único del COVID-19 o son un indicador general de la gravedad de la inflamación con COVID-19.
Los perfiles proteómicos séricos de pacientes con SARS identificaron un fragmento N-terminal del complemento C3C-α (un componente fundamental de la vía del complemento) como un biomarcador sensible del SARS temprano.
Los modelos murinos de SARS y síndrome respiratorio de Oriente Medio han demostrado que la activación del complemento es un contribuyente importante de la lesión pulmonar y otras fallas orgánicas. La inhibición del complemento en estos modelos redujo el daño orgánico e inflamatorio, lo que ha llevado a sugerirla como tratamiento del COVID-19, pero faltan datos clínicos.
Un mecanismo de la trombosis microvascular que puede ser específico del COVID-19 es su afinidad por la enzima convertidora de angiotensina 2, que se expresa en las células epiteliales alveolares de tipo II y en otros tejidos, incluidas las células endoteliales. La activación de estas células puede ser un mecanismo único de la lesión microvascular mediada por COVID-19, y de la trombosis e insuficiencia orgánica multisistémica subsiguientes.
Según los autores, la tasa de 87,7% de positividad para el anticoagulante lúpico en pacientes con COVID-19 informada por Helms et al es sorprendente y debe ser verificada, pero apoya la idea de que la lesión endotelial es un mecanismo clave de la insuficiencia multiorgánico y la coagulopatía en esta enfermedad.
Los modelos de "dos hits" (N. del T.: dos eventos, dos impactos) de trombosis asociada al síndrome antifosfolípidos propone que después del primer impacto se produce la lesión es en el endotelio, mientras que en el segundo impacto, los anticuerpos antifosfolípidos potencian la formación de trombos. La activación del sistema de contacto debido al aumento de la permeabilidad vascular y la microangiopatía trombótica justifican profundizar los estudios.
| Pautas de manejo porpuestas por los autores |
El enfoque descrito aquí describe el Consenso de la Cleveland Clinic, basado en la información. Intenta equilibrar el riesgo y los beneficios de la terapia empírica, minimizando al mismo tiempo el uso de recursos (por ej., equipo de protección personal) y exposición de los cuidadores al COVID-19.
> Monitorear el dímero D, fibrinógeno, tiempo de protrombina, tiempo de parcial de tromboplastina activada
En vista de los hallazgos de laboratorio característicos de la CAC descritos antes, los autores monitorean dímero D, fibrinógeno, cociente tiempo de protrombina-RIN y tiempo parcial de tromboplastina activada cada 48 horas.
Ellos consideran de alto riesgo el hallazgo de un nivel de dímero D al menos 6 veces más elevado que el nivel superior normal (3,0 μg/ ml unidades equivalentes de fibrinógeno o [FEU], del inglés).Debido a a que se han hallado anticuerpos antifosfolípidos en la infección por COVID-19, incluido el anticoagulante lúpico, los autores recomiendan buscarlos cuando el tiempo parcial de tromboplastina activada se ha elevado espontáneamente aunque para controlar la anticoagulación prefieren usar ensayos anti-Xa.
Sin embargo, estos ensayos pueden verse afectados en presencia de hiperbilirrubinemia (>6,6 mg/dl) o hipertrigliceridemia (>360 mg/dl), que a menudo están preentes en pacientes con COVID-19 y tormenta de citocinas.
Por lo tanto, se deben monitorear rutinariamente los niveles de triglicéridos y considerarlos una posible causa de error en los pacientes anticoagulados que tienen dificultad para mantenerse dentro del rango del objetivo terapéutico.
En varias publicaciones se ha descrito un patrón de hipercoagulabilidad en las pruebas viscoelásticas (tromboelastografía o tromboelastometría rotacional), con tiempos de formación del coágulo y propagación del coágulo
más rápidos y, aumento de la fuerza del coágulo. Sin embargo, no hay evidencia sobre cómo utilizar mejor esta información para guiar la terapia. De acuerdo con las guías actuales de la American Society of Hematology y la International Society on Thrombosis and Haemostasis, “no utilizamos rutinariamente pruebas viscoelásticas para evaluar la hipercoagulabilidad.”
> Imágenes: uso de POCUS
Para limitar la exposición del cuidador, los autores minimizan los estudios vasculares formales a la cabecera del paciente, y para realizar la angiotomografía computarizada lo envían fuera de la unidad de cuidados intensivos. “Confiamos mucho en POCUS para evaluar la presencia de tromboembolismo venoso”, dicen.
Esto coincide con las recientes recomendaciones de National Institutes of Health, que menciona la falta de evidencia que respalde los exámenes de detección de rutina, pero destaca el valor de POCUS en manos experimentadas. POCUS debe estar junto con otros cuidados (por ej., acceso vascular guiado por ecografía) para minimizar el uso de equipo de protección personal y exposición del cuidador al COVID-19.
En los pacientes de alto riesgo se investiga la trombosis venosa profunda mediante un examen POCUS de compresión de 3 puntos, de ambas extremidades inferiores. POCUS de una vena profunda y ecocardiografía; también se recomiendan para cualquier paciente con deterioro cardiopulmonar repentino que no pueda explicarse por otra etiología.
La detección de trombosis venosa mediante POCUS es muy específica y no requiere confirmación mediante ecografía vascular formal.Por otro lado, dada la elevada incidencia de embolia pulmonar, los estudios confirmatorios (ecografía vascular formal o angiotomografía computarizada) están justificados si el paciente tiene contraindicaciones para la anticoagulación empírica y la sospecha clínica de tromboembolismo venoso es elevada, a pesar de POCUS negativo o, si POCUS no está disponible.
> Heparina profiláctica para la mayoría
Los datos específicos sobre el manejo de CAC son extremadamente limitados, pero la heparina parece ser la indicación obvia para un poroceso de hipercoagulabilidad.Además de su efecto antitrombótico, la heparina puede tener efectos antiinflamatorios, anticomplemento y antivirales directos que pueden ser beneficiosos en la infección por COVID-19. La heparina inhibe la activación de los neutrófilos, se une a las citocinas inflamatorias y reduce la activación del endotelio.
Los modelos experimentales también demuestran que la heparina se une directamente a la proteína pico del SARS-CoV, el sitio de anclaje viral, bloqueando así la entrada del virus a la célula. Aunque prometedores, estos efectos aún no han sido demostrados clínicamente.
Basados en un estudio, los autores expresan que la heparina reduce las tasas de mortalidad en pacientes con COVID-19 grave y citan una declaración de consenso china que recomienda la anticoagulación en COVID-19 grave, aunque dicho estudio comparó retrospectivamente la profilaxis con heparina con ninguna profilaxis.
> ¿Anticoagulación completa para algunos?
Cierta evidencia indica que los niveles de dímero D elevados pueden predecir un riesgo mayor de tromboembolismo venoso, a pesar de la profilaxis estándar. Maatman et al informaron que el 28% de los pacientes con COVID-19que recibieron profilaxis estándar sufrieron tromboembolismo venoso.
El dímero D elevado (>2,6 μg/ml) predijo el tromboembolismo venoso grave con una sensibilidad del 89,7%. Los autores concluyeron que las dosis profilácticas estándar de anticoagulantes pueden ser insuficientes para prevenir el tromboembolismo en pacientes de alto riesgo.
Paranjpe et al, en un informe de observación de 2.773 pacientes con COVID-19, ingresados en una sola institución de Nueva York, hallaron que los que recibieron anticoagulación completa (786 pacientes, 28%) tuvieron una tasa de mortalidad similar (22,5%) a la de los tratados con profilaxis solamente (22,8%).
Pero entre los pacientes mecánicamente ventilados, la mortalidad hospitalaria fue 29,1% para los tratados con anticoagulación vs. 62,7% de aquellos no anticoagulados. A pesar de esta dramática reducción de la mortalidad, los autores aconsejan precaución al aplicar estos hallazgos, dadas las serias limitaciones del informe, es decir, su naturaleza observacional y la falta de información sobre la gravedad de la enfermedad de los que fueron anticoagulados.
En conjunto, esta evidencia limitada confirma que la profilaxis contra la tromboembolia venosa en pacientes críticamente enfermos con COVID-19 se asocia con mejores resultados, y puede tener un papel en la anticoagulación completa.
Dadas las limitaciones de los estudios, no está claro si una dosis profiláctica más elevada que la estándar o la anticoagulación total son beneficiosas, o que los pacientes puedan beneficiarse sin sufrir más complicaciones hemorrágicas.
También se ha sugerido la trombólisis para pacientes cuya condición se deteriora a pesar de la anticoagulación. Tres pacientes con persistente hipoxia severa y dímero D marcadamente elevado mostraron mejoría de la oxigenación después de una dosis baja de activador del plasminógeno tisular. Pero, a pesar de la mejora inicial y de no haberse informado efectos adversos, el resultado final fue malo: la mejoría fue duradera en 1 paciente y transitoria en los otros 2, y 1 paciente falleció.
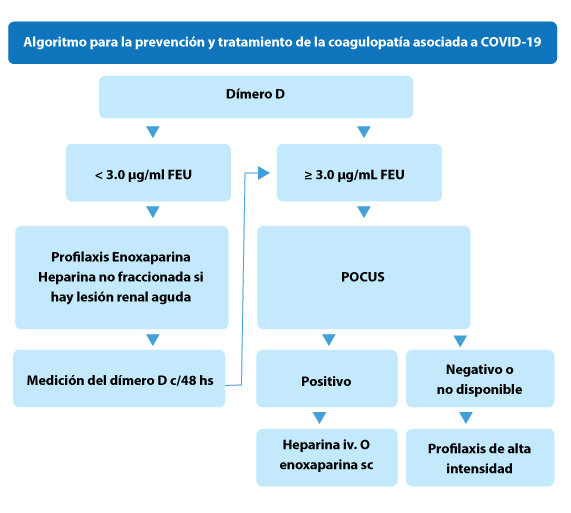
Dada esta falta de evidencia, las dos sociedades médicas mencionadas no recomiendan hacer otro tratamiento más que la profilaxis estándar, excepto para una indicación establecida, y recomiendan encarecidamente la profilaxis contra la trombosis venosa en todos los pacientes al ingreso, usando heparina de bajo peso molecular (o heparina no fraccionada para aquellos con insuficiencia renal (o fondaparina para aquellos con trombocitopenia inducida por heparina).
Destacan que la profilaxis debe continuarse incluso en el contexto de trombocitopenia, siempre que el recuento de plaquetas sea >25×109/l.“Nuestro enfoque actual”, dicen,“se basa en la detección del tromboembolismo venoso mediante POCUS y la profilaxis intensificada en pacientes de alto riesgo.” Y dividen a los pacientes en 3 categorías:
• Categoría 1: dímero D >3,0 μg/ml FEU, sin evidencia de tromboembolismo venoso. Los pacientes reciben profilaxis estándar y se controlan mediante la prueba de dímero D.
• Categoría 2: dímero D ≥3,0 μg/ml FEU, POCUS negativo. Los pacientes reciben profilaxis intensificada de la trombosis venosa profunda.
• Categoría 3: Trombosis confirmada. Los pacientes reciben anticoagulación completa. Si hay una elevada sospecha clínica de tromboembolismo venoso y el paciente no tiene contraindicación para la anticoagulación, y las pruebas POCUS o confirmatorias no están disponibles de inmediato, se debe comenzar la anticoagulación completa empírica.
| Enfoque de la Cleveland Clinic para la anticoagulación profiláctica y manejo del COVID-19 | |||
| Categoría 1 Profilaxis estándar | Categoría 2 Profilaxis intensificada de la TVP | Categoría 3 TEV. Anticoagulación completa empírica | |
| Estándar | Enoxaparina 40 mg. sc. c/24 has | Enoxaparina 40 mg. sc c/24 hs | Heparina iv. Nomograma TVP/EP o, enoxaparina 1 mg/kg, sc, c/12 hs |
| Insuficiencia renal | ClCr 10–30 ml/min: Enoxaparina 30 mg. SC c/24 hs ClCr <10 mL/min o LRA: heparina no fraccionada 5.000 U,sc, c/12 hs TRRC: heparina no fraccionada 500 U/hora, en el circuito Coagulación en el circuito: heparin IV nomograma SCA | ClCR<30 ml/min: Enoxaparina 40 mg. sc c/24h ClCr <10 ml/min o LRA: heparina no fraccionada 7.500 U, sc, c/12 hs TRRC: heparina no fraccionada 500 U/hora, en el circuito. Coagulación en el circuito: heparina IV nomograma SCA | Heparina iv. Nomograma TVP/EP |
| Obesidad | |||
| Estándar | >100 kg: Enoxaparina 40 mg, sc, c/12 hs. >120 kg: Enoxaparina 60 mg, sc, c/12 hs | 100 kg: Enoxaparina 60 mg, sc, c8 hs. 120 kg: Enoxaparina 80 mg, sc, c/12 hs | Heparina iv. Nomograma TVP/EP o, Enoxaparina, 1 mg/kg, sc, c/12 hs. hasta 150 mg. |
| Insuficiencia renal ClCr < 30 ml/min o LRA | ≤ 120 kg: 7.500 U c/12 hs > 120 kg: 10.000 U c/12 hs TRRC: heparina no fraccionada 500 U/hora, en el circuito Coagulación en el circuito: heparina IV nomograma SCA | ≤ 120 kg: 7.500 U c/8 hs > 120 kg: 10.000 U c/8 hs TRRC: heparina no fraccionada 500 U/hora, en el circuito Coagulación en el circuito: heparina IV nomograma SCA | Heparina iv. Nomograma TVP/EP |
| ClCr: Clearance de creatinina. EP: embolismo pulmonar. SCA: síndrome coronario agudo. TEV: tromboembolismo venoso. TRRC: terapia de reemplazo renal continua.: TVP. Trombosis venosa profunda. | |||
Dada la elevada tasa de coagulación en los circuitos de diálisis, todos los pacientes en terapia de reemplazo renal continua reciben heparina no fraccionada (500 U/hora). Si se observa coagulación en curso, se aumenta la heparina sistémica para alcanzar un tiempo parcial de tromboplastina activada en el rango objetivo, semejante al nomograma del síndrome coronario agudo.
El tiempo de parcial de tromboplastina activada objetivo es de 49 a 67 segundos, y el nivel objetivo de antifactor Xa es de 0,2 a 0,5 UI/ml, pero estos pueden ajustarse si la coagulación continúa a pesar de la heparina sistémica.
> Duración de la anticoagulación
La anticoagulación debe continuarse durante 6 semanas para la trombosis asociada al catéter y al menos 3 meses para la tromboembolia venosa. Los pacientes convalecientes con persistencia de niveles elevados de dímero D (más del doble del límite superior normal) pueden beneficiarse de la profilaxis o el tratamiento.
Resumen y comentario objetivo: Dra. Marta Papponetti
































No hay comentarios:
Publicar un comentario