
Descrita una proteína esencial para la infección por el virus de Epstein-Barr
Dos estudios publicados en Nature Communications descubren la estructura del portal del virus de Epstein-Barr y del bacteriófago T7. En la actualidad no existe tratamiento para las infecciones causadas por dicho virus que, además de causar mononucleosis, provoca varios tipos de cáncer.
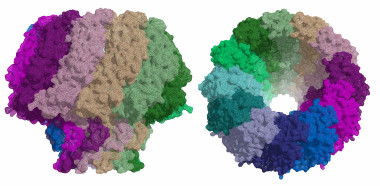
Estructura de la proteína portal del virus de Epstein-Barr. / Cristina Machón, IRB Barcelona.
Expertos del Instituto de Investigación Biomédica (IRB Barcelona) y del Instituto de Biología Molecular de Barcelona (IBMB-CSIC) han publicado en la revista Nature Communications la estructura de una proteína esencial para el proceso de infección del virus de Epstein-Barr, conocido como portal.
El virus de Epstein-Barr, perteneciente a la familia de los herpesvirus, es uno de los virus humanos más comunes y la principal causa de la mononucleosis infecciosa (la llamada enfermedad del beso), además de provocar diversos tipos de cáncer como los linfomas de Burkitt y Hodgkins, cáncer gástrico y cáncer nasofaríngeo, así como varias enfermedades autoinmunes. En la actualidad no existe tratamiento para las infecciones producidas por este virus.
Conocer la estructura de la proteína portal es útil para diseñar inhibidores que puedan ser utilizados contra las infecciones por herpesvirus
“Conocer la estructura de la proteína portal podría ser útil para el diseño de inhibidores que puedan ser utilizados para el tratamiento de infecciones por herpesvirus, como el de Epstein-Barr. Además, al tratarse de una proteína exclusiva de herpesvirus, estos inhibidores serían específicos contra el virus y quizás menos tóxicos para los humanos”, comenta Miquel Coll, jefe del Laboratorio de Biología Estructural de Complejos de Proteínas y Ácidos Nucleicos y Máquinas Moleculares del IRB Barcleona y profesor del CSIC.
Todos los herpesvirus tienen un sistema de infección similar: una vez entran en el interior celular y alcanzan el núcleo, los virus liberan su ADN, que puede esconderse latente durante años hasta que, ante determinadas circunstancias, se desencadena su multiplicación.
El ADN es replicado y posteriormente introducido en nuevas cápsides virales, para así formar nuevos virus que atacarán otras células. La proteína portal es el canal por donde el ADN entra en la cápside del virus y por donde sale al infectar las células.
Segundo trabajo
En un segundo trabajo publicado recientemente en la misma revista, los investigadores han caracterizado también la estructura de la proteína portal en el bacteriófago T7. El bacteriófago T7 es un virus que infecta exclusivamente a bacterias y, curiosamente, utiliza un sistema muy parecido al de los herpesvirus para el empaquetamiento de su ADN.
Los investigadores utilizaron tanto técnicas de difracción de rayos X de sincrotrón como criomicroscopía electrónica de alta resolución
“Gracias a la estructura de la proteína portal del bacteriófago T7 hemos podido inferir como funcionaría la de Epstein-Barr” explican Cristina Machón y Montserrat Fàbrega investigadoras postdoctorales del IRB Barcelona y del IBMB-CSIC y primeras autoras –junto con Ana Cuervo, del Centro Nacional de Biotecnología (CNB-CSIC)– de los trabajos publicados.
“En ambos virus, la proteína portal está compuesta por 12 subunidades, formando una gran estructura en forma de champiñón, con un canal central por el que pasa el ADN. Este canal presenta una válvula que regula la entrada y salida del material genético del virus” explica Coll.
Para estudiar la estructura de esta proteína, los investigadores utilizaron tanto técnicas de difracción de rayos X de sincrotrón como criomicroscopía electrónica de alta resolución. Ambos estudios fueron llevados a cabo en colaboración con el CNB-CSIC y la Universidad de Oxford (Reino Unido).
Referencias bibliográficas:
Cristina Machón, Montserrat Fàbrega-Ferrer, Daming Zhou, Ana Cuervo, José L. Carrascosa, David I. Stuart and Miquel Coll. Atomic structure of the Epstein-Barr virus portal. Nature Communications (2019) DOI: www.doi.org/10.1038/s41467-019-11706-8
Ana Cuervo, Montserrat Fàbrega-Ferrer, Cristina Machón, José Javier Conesa, Francisco J. Fernández, Rosa Pérez-Luque, Mar Pérez-Ruiz, Joan Pous, María Cristina Vega, José L. Carrascosa and Miquel Coll. Structures of T7 bacteriophage portal and tail suggest a viral DNA retention and ejection mechanism. Nature Communications (2019) DOI: www.doi.org/10.1038/s41467-019-11705-9
Los estudios han contado con financiación del programa de excelencia “Severo Ochoa” y “María de Maeztu”, el programa “Ramón y Cajal” del Ministerio de Ciencia, Innovación y Universidades, y los proyectos europeos iNEXT y Instruct-ERIC.
































No hay comentarios:
Publicar un comentario