
Rucaparib fue aprobado como tratamiento de mantenimiento para algunos cánceres recidivantes de ovario
31 de mayo de 2018 por Equipo del NCI
La Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos amplió la aprobación de la terapia dirigida rucaparib (Rubraca) para el tratamiento de mujeres con cáncer de ovario.
La aprobación cubre el uso de rucaparib como tratamiento de seguimiento, o terapia de mantenimiento, para mujeres cuyo cáncer de ovario ha vuelto después del tratamiento inicial y cuyos tumores se redujeron, al menos en forma parcial, durante el tratamiento subsecuente con quimioterapia con derivados del platino. La aprobación, anunciada el 6 de abril, también abarca a las mujeres con cáncer de trompas de Falopio o cáncer primario peritoneal.
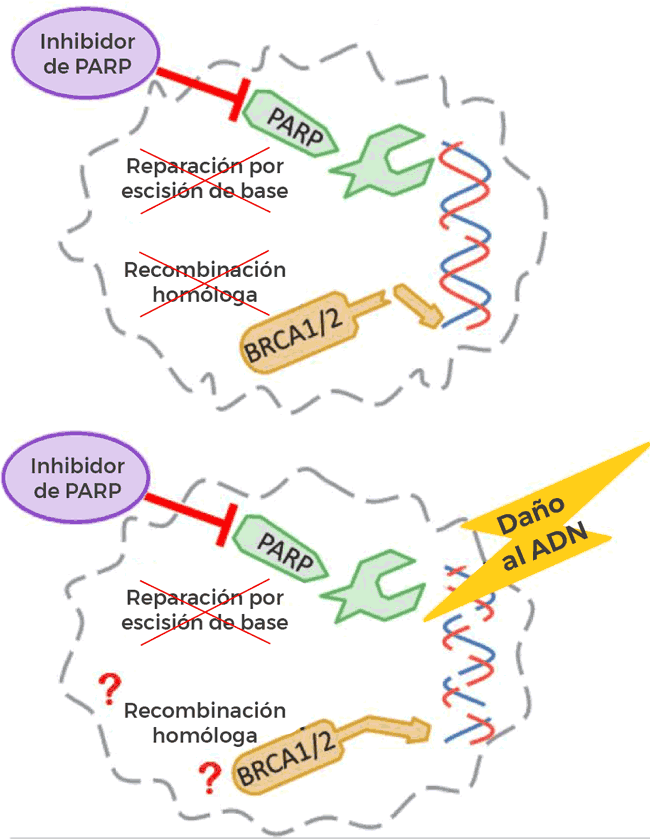
Rucaparib es un tipo de fármaco llamado inhibidor de PARP, el cual impide que las células reparen el daño a su ADN. Rucaparib, después de olaparib (Lynparza) y niraparib (Zejula), es el tercer inhibidor de PARP aprobado como terapia de mantenimiento para mujeres con cáncer recidivante de ovario, de trompas de Falopio o peritoneal primario que aún responden a quimioterapias con derivados del platino.
La doctora Elise Kohn, directora de Terapéutica de Cánceres Ginecológicos en la División de Tratamiento y Diagnóstico de Cáncer del NCI, explicó que la novedad de la aprobación de rucaparib radica en que incluye la aprobación de la primera prueba complementaria de diagnóstico que mide posibles indicadores de sensibilidad a PARP. La prueba, denominada FoundationFocus CDxBRCA LOH, puede predecir cuáles tumores responderán más probablemente al tratamiento.
Bajo la aprobación, rucaparib podrá recetarse sin esta prueba. Sin embargo, la doctora Kohn explicó, los resultados de esta prueba—o de otras pruebas similares que están siendo formuladas—ayudarán a los pacientes y sus doctores a decidir si se usará alguna terapia de mantenimiento y cuál será más conveniente, tomando en cuenta también los problemas médicos de los individuos y las metas de tratamiento, agregó la doctora Kohn.
Interrupción de la reparación del ADN en las células cancerosas
La mayoría de las células tienen varios mecanismos moleculares para reparar el ADN, y las proteínas PARP forman parte de solo uno de estos mecanismos. Esto significa que los fármacos como rucaparib, que actúan bloqueando la actividad de las proteínas PARP, son más eficaces en las células cancerosas que ya tienen daños en otros mecanismos de reparación del ADN, explicó el doctor Robert Coleman, del Centro Oncológico MD Anderson de la Universidad de Texas.
En estudios clínicos anteriores de inhibidores de PARP se halló que funcionaban mejor en pacientes con mutaciones en los genes BRCA1 y BRCA2, que cumplen importantes funciones en la reparación del ADN.
Sin embargo, las investigaciones en curso indican que los inhibidores de PARP podrían actuar también en tumores con otros tipos de defectos en la reparación del ADN, incluida una amplia categoría de defectos denominada deficiencia de la recombinación homóloga (HRD). La prueba complementaria de diagnóstico aprobada con rucaparib analiza tumores para detectar la deficiencia HRD y las mutaciones en el gen BRCA.
Menos reparación, mayor beneficio
En el estudio de distribución al azar en fase 3, denominado ARIEL3, que determinó la nueva aprobación para rucaparib, los investigadores dirigidos por el doctor Coleman inscribieron a 564 mujeres con cáncer recidivante de ovario, de trompas de Falopio o peritoneal primario. ARIEL 3 fue financiado por Clovis Oncology, Inc., el fabricante de rucaparib.
Todas las mujeres en el estudio estaban respondiendo a la quimioterapia con derivados de platino, de manera completa o parcial. Después de analizar los tumores de las participantes con la prueba complementaria de diagnóstico, los investigadores asignaron al azar a 375 para recibir rucaparib, que se administra diariamente en forma de comprimido, y a 189 para recibir un placebo. Las mujeres siguieron el tratamiento hasta que el cáncer empeoró, cuando fallecieron u optaron por interrumpir el tratamiento debido a los efectos secundarios o por otras razones.
En general, las mujeres que recibieron rucaparib tuvieron más tiempo antes de que la enfermedad empeorara (supervivencia sin avance) que las mujeres en el grupo del placebo: 10,8 meses en comparación con 5,4 meses. El beneficio de rucaparib fue más fuerte en pacientes con defectos en la reparación del ADN, tal como se midió mediante la prueba complementaria de diagnóstico. Las mujeres con tumores con HRD pero sin mutaciones en la línea germinal (heredada) en el gen BRCA que recibieron rucaparib, vivieron una mediana de 13,6 meses sin avance de la enfermedad. Las mujeres con mutaciones en la línea germinal (heredada) en el gen BRCA tratadas con rucaparib tuvieron una mediana de supervivencia sin avance de16,6 meses.
Los efectos secundarios graves fueron más comunes en las mujeres que recibieron rucaparib, por ejemplo, anemia, náuseas y dolores de cabeza. La doctora Kohn explicó que estos efectos secundarios son frecuentes en mujeres tratadas con cualquiera de los inhibidores de PARP. Dos pacientes del grupo de rucaparib murieron debido a cánceres secundarios relacionados con el tratamiento, mientras que en el grupo del placebo no murió ninguna paciente.
Los investigadores del estudio ARIEL3 continúan el seguimiento de participantes a través del tiempo, a fin de observar si el tratamiento con rucaparib mejora cuánto viven las mujeres en general (supervivencia general).
Vías futuras para los inhibidores de PARP
Conforme los médicos se sientan más cómodos al usar pruebas complementarias de diagnóstico para medir la HRD y otros biomarcadores a fin de estimar la vulnerabilidad potencial de un tumor ante la inhibición de PARP, el doctor Coleman comentó que "pueden llegar a ser herramientas importantes para la toma de decisiones".
El doctor Coleman explicó que los estudios clínicos futuros probablemente investiguen la administración más temprana de la terapia de mantenimiento con inhibidores de PARP en el tratamiento del cáncer de ovario, después de la terapia inicial (llamada mantenimiento primario).
Los investigadores están también interesados en estudiar a los inhibidores de PARP como tratamiento inicial, o de primera línea, en cánceres de ovario con BRCA y sin BRCA, continuó el doctor Coleman.
La doctora Kohn explicó que la investigación de los inhibidores de PARP se ha ampliado también para incluir combinaciones con inmunoterapias, como los inhibidores de puntos de control inmunitario, y con terapias dirigidas, como cediranib. "La [iniciativa] para estudiar cómo aprovechar la actividad de los inhibidores de PARP en terapias combinadas es enorme. Ese es el próximo paso", dijo la doctora.
Muchos de estos estudios se basan en nuevos conocimientos sobre los mecanismos de reparación del ADN que se obtuvieron al estudiar por qué algunos tumores son resistentes a la inhibición de PARP, lo que a su vez ha llevado a la formulación de nuevos fármacos dirigidos a la reparación del ADN, continuó la doctora.
"Se trata de un ciclo realmente positivo que ha resultado en un cambio bienvenido", concluyó la doctora Kohn.
































No hay comentarios:
Publicar un comentario