
Revisión en profundidad | 17 MAR 19
Diagnóstico y tratamiento de la EPOC
Amplia revisión que información práctica sobre el diagnóstico y manejo a largo plazo de la EPOC en el ámbito ambulatorio

Autor: Craig M. Riley, Frank C. Sciurba JAMA. 2019;321(8):786-797
Página1
| Introducción |
Aunque en EE. UU. más del 75% de los diagnósticos de EPOC está relacionado con el humo del tabaco, otras partículas ocupacionales o ambientales o la exposición a gases como el escape de diesel y el humo del interior de la cocina contribuyen con el desarrollo de la EPOC.
| Esta enfermedad es un síndrome heterogéneo provocado por procesos fisiopatológicos con mecanismos diferentes, como la respuesta inmunológica de tipo TH1 innata y adaptativa a las toxinas, microbios o autoinmunidad; la inflamación persistente de TH2; la deficiencia de antiproteasa y otros mecanismos que afectan a las vías respiratorias, los alvéolos o ambos, resultando en diversas presentaciones clínicas, respuestas al tratamiento y patrones de progresión. |
En el ámbito ambulatorio son los médicos de atención primaria quienes tratan a la mayoría de los pacientes con EPOC. Se calcula que el 3,2% de todas las visitas al consultorio de atención primaria corresponden a la EPOC.
| Discusión |
La EPOC se presenta típicamente con ≥1 síntomas de disnea de esfuerzo, tos, producción de esputo, opresión en el pecho o fatiga. Los pacientes que realizan una actividad física mínima pueden subinformar los síntomas; por lo que es importante obtener una historia minuciosa.
Se puede completar con herramientas de evaluación de síntomas como la Medical Research Council (mMRC) (Escala de disnea del Consejo de Investigación modificada (0 a 4 puntos) y, la prueba de evaluación de la EPOC (CAT), que se recomiendan para estratificar y monitorear la progresión.
La CAT es una escala de síntomas de 8 preguntas, de 0 a 40 puntos, que incluye la evaluación de la frecuencia la tos, cantidad de flema, opresión en el pecho, tolerancia al subir pendientes o escaleras, nivel de actividades hogareñas, inseguridad fuera del hogar, sueño reparador y nivel de energía.
Un historial de exposición a partículas o humos inhalados como. El antecedente de exposición al humo del tabaco o la cocción en interiores apoya el diagnóstico de EPOC.Aunque en EE. UU. el principal factor de riesgo es el humo del tabaco, que contribuye al 75% de los casos, el humo de leña y otros combustibles utilizados para cocinar y calentar, como el polvo ocupacional y la exposición a humos químicos están implicados en aproximadamente el 25% de los pacientes con EPOC que nunca fumaron.
El nacimiento prematuro, las infecciones respiratorias severas en la niñez y el asma mal controlada se asocian con una función pulmonar pico en el adulto más baja, aumentando hasta 12,5 veces las probabilidades de EPOC después de las exposiciones.
La espirometría es el estándar de referencia para el diagnóstico y evaluación de la severidad y si muestra obstrucción, a los 15 minutos deberá repetirse la prueba luego de administrar un broncodilatador de acción corta. El sello de la EPOC es la obstrucción reversible.
| Para establecer el diagnóstico de obstrucción, la guía de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) recomienda usar el valor fijo 0,7 del cociente fijo FEV1/FVC (volumen espiratorio forzado en el primer segundo/capacidad vital forzada). |
No se recomienda el cribado espirométrico poblacional; sino que la espirometría debe hacerse en pacientes con síntomas de EPOC y antecedentes de exposiciones.El examen físico es útil para evaluar los signos de hiperinsuflación pulmonar en la enfermedad avanzada o descartar diagnósticos alternativos relacionados con la afectación de órganos no pulmonares. Las sibilancias y los roncus rara vez se presentan en la EPOC estable, por lo tanto su presencia puede indicar una exacerbación aguda, mientras que los estertores sugieren fibrosis pulmonar o insuficiencia cardíaca congestiva.
La auscultación espiración prolongada en la tráquea durante un esfuerzo forzado máximo puede ser útil en el diagnóstico precoz de la obstrucción o cuando la espirometría no está disponible. Para los pacientes que tienen disnea se recomienda la oximetría de pulso en reposo para evaluar la necesidad de oxígenoterapia suplementari.
Si bien las imágenes de la tomografía computarizada (TC) no son necesarias para el diagnóstico de EPOC, algunos expertos la recomiendan para los pacientes que no responden satisfactoriamente al tratamiento y descartar otras afecciones pulmonares comórbidas como bronquiectasias o fibrosis pulmonar.
Se recomienda la detección de la deficiencia de α1-antitripsina en todos los pacientes con EPOC porque solo el 5% de los pacientes con deficiencia han sido diagnosticados. Es importante porque la infusión intravenosa de α1-antitripsina en individuos con obstrucción moderada a grave por esa deficiencia pueden retardar la progresión al enfisema.
El cribado de cáncer de pulmón con TC en baja dosis hace la detección precoz y reduce la mortalidad global relativa causalidad total un 6,7% y la mortalidad relativa específica por cáncer de pulmón: en un 20%, en pacientes adecuadamente seleccionados (edad, 55 s 80 años, historia de fumar ≥30 paquetes de cigarrillos/año), fumador actualo abandono del cigarrillo dentro de los 15 años, y expectativa de vida no limitada por otra enfermedad terminal).
El riesgo de cáncer de pulmón es mayor en los pacientes con EPOC, y la presencia de enfisema radiográfico se asocia con un riesgo relativo de 3,3 veces de que un nódulo pulmonar descubierto accidentalmente sea maligno, en comparación con los controles apareados por edad y tabaquismo.
| Pronóstico y estratificación de riesgos |
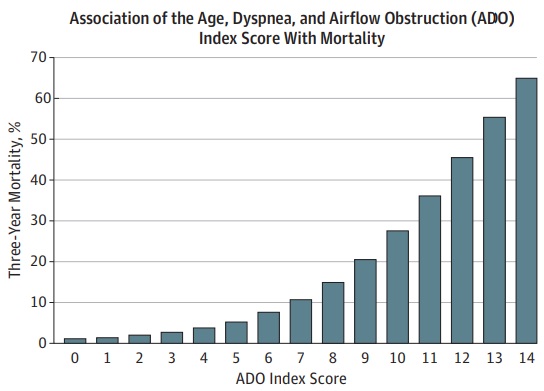
El riesgo de mortalidad se puede predecir usando la edad, la disnea, el índice de obstrucción del flujo de aire, que incorpora la edad, la escala de disnea mMRC y el FEV1, medidas éstas que son fácilmente accesibles en un entorno de atención primaria.
El índice de masa corporal, la obstrucción, la disnea y el índice de ejercicio también predicen la mortalidad e incorpora las implicaciones de un pronóstico negativo de un índice de masa corporal de ≤2, FEV1, mMRC, y la prueba de la caminata de 6 minutos.
| Enfoque terapéutico |
Las terapias pueden ser intensificadas, agregadas o retiradas, según la respuesta del paciente y su posterior curso clínico.Para dejar de fumar se utiliza la combinación de cambios de conducta y la acción farmacológica (incluida la terapia de reemplazo de nicotina, bupropión y vareniclina), pues han demostrado eficacia y debe alentarse en cada visita. La vacunación anual contra la influenza reduce las exacerbaciones de la EPOC.
Se deben administrar vacunas contra el neumococo, en especial la vacuna antineumocócica 23 valente, para todos los pacientes con EPOC o fumadores actuales. La vacuna de conjugado neumocócico de 13 valencias se recomienda para pacientes con EPOC de ≥65 años y para pacientes más jóvenes con fragilidad o que requieren esteroides sistémicos frecuentes.
| Broncodilatadores |
- Los agonistas β2 se unen a los receptores adrenérgicos β2 en las células musculares lisas de la vía aérea, favoreciendo la broncodilatación y aumentando la frecuencia de batido ciliar.
- Los antagonistas muscarínicos bloquean los receptores muscarínico M1 y M3 previniendo la broncoconstricción parasimpática del músculo liso de las vías respiratorias e inhibiendo la secreción de moco de las células caliciformes.
Los broncodilatadores de acción corta son los agonistas β2 de acción corta (SABA) albuterol y levalbuterol y, el antagonista muscarínico de acción corta (SAMA) ipratropio. Puede ser utilizado según sea necesario, solo o combinado en pacientes con síntomas limitados o disnea con ciertas actividades pero no son apropiadas como terapias programadas para los pacientes con antecedente de exacerbaciones o síntomas persistentes.
Para pacientes que usan broncodilatadores de acción corta más de 2-3 veces por semana, se recomienda el tratamiento broncodilatador de mantenimiento prolongado.
| Los broncodilatadores pueden mejorar los síntomas reduciendo la hiperinflación pulmonar y mejorando la eficiencia muscular inspiratoria. incluso en pacientes sin evidencia espirométrica de reversibilidad con los broncodilatadores. |
Los β2-agonistas (LABA) de acción prolongada como formoterol, vilanterol, lodaterol, indacaterol o arformoterol, y los antagonistas muscarínicos de acción prolongada (LAMA) como tiotropio, umeclidinium, glicopirrolato, aclidinio o revefenacina reducen el puntaje de los síntomas y disminuye el riesgo de exacerbación, siendo los LAMA los únicos agentes más efectivos.
La combinación de broncodilatadores de acción prolongada dual que contienen LAMA y LABA: tiotropio más olodaterol, vilanterol más umeclidinium, indacaterol más glicopirrolato o, formoterol más glicopirrolato, proporcionan una mejoría promedio mayor de la función pulmonar, el puntaje de síntomas y el riesgo de exacerbación, en comparación con cada componente por separado.
Por lo tanto, para los pacientes con una carga inicial de síntomas elevada o historia de exacerbaciones, se recomienda iniciar el tratamiento con la combinación de agentes LAMA y LABA.
El riesgo de eventos cardíacos adversos importantes por provocados por los broncodilatadores de acción prolongada no es diferente del placebo en ensayos clínicos y es similar en los regímenes duales, en comparación con el uso de los componentes por separado.
Restos riesgo pueden estar subestimados en los ensayos clínicos que suelen excluir a los pacientes con enfermedad de las arterias coronarias, insuficiencia cardíaca o taquiarritmias.
| Corticosteroides inhalados |
Los corticosteroides inhalados disminuyen la inflamación de las vías respiratorias y son el tratamiento de primera línea del asma.En 3 ensayos importantes (IMPAC, TRIBUTE, KRONOS) se ha comprobado que el agregado de corticosteroides inhalados a la terapia combinada de LAMA y LABA para el tratamiento de la EPOC, consigue una modesta mejoría de la función pulmonar y disminuciones significativas de las tasas de exacerbaciones.
Los beneficios de los corticosteroides inhalados deben equilibrarse con el riesgo 1,7 veces mayor de neumonía bacteriana.
Otras complicaciones son, en comparación con el placebo, el aumento de aftas (9%), ronquera (5%) y moretones en la piel (8%). Para mitigar la candidiasis es importante que los pacientes se enjuaguen la boca después del uso de los corticosteroides inhalados y utilicen un espaciador con inhalador de dosis medida a presión.
El número de eosinófilos en el hemograma de sangre periférica es un biomarcador útil para seleccionar a los pacientes con relación riesgo/beneficio más favorable para el tratamiento con corticosteroides inhalados.
En cada uno de los ensayos antes mencionados se comprobó una mejor respuesta a los corticosteroides inhalados en presencia de un número más elevado de eosinófilos.
Específicamente, en el ensayo IMPACT, los corticosteroides inhalados en la terapia triple se asociaron con 30 exacerbaciones menos por cada 100 pacientes-años que los pacientes tratados con combinación LAMA y LABA.
Para los pacientes con niveles de eosinófilos en sangre periférica de ≥150 células/μl, el uso de corticosteroides inhalados redujo la tasa de exacerbaciones en 44/100 pacientes-año, mientras que los niveles <150 células/μl tuvieron una reducción de solo 12 eventos/cada 100 pacientes-años.
Estos efectos deben ser equilibrado contra un aumento en las tasas de neumonía de 3,6/100 pacientes-años en el grupo de corticosteroides inhalados. Un análisis retrospectivo que comparó corticosteroides inhalados combinados y LABA con Solo LABA justificó aún más estos hallazgos.
Los pacientes con niveles de eosinófilos en sangre periférica <100 células/μl no obtuvieron ningún beneficio con el agregado de corticosteroides inhalados en cuanto a los resultados del puntaje de síntomas, FEV1 y tasa de exacerbaciones, mientras que la respuesta relativa en todas las medidas mejoró con el aumento de los niveles de eosinófilos >100 células/μl. La mayor mejoría relativa se observó con niveles de eosinófilos en sangre periférica >300 células/μl.
En los pacientes que demostraron una estabilidad prolongada de al menos 2 años sin una exacerbación de moderada a grave, o para quienes el corticosteroide inhalado haya sido administrado de manera inadecuada, e debe considerar el retiro de los corticosteroides inhalados para comenzar a seguir los lineamientos actuales de ensayo WISDOM, para pacientes con obstrucción severa (FEV1 <50% previsto) y al menos 1 exacerbación en el año anterior.
Estos pacientes fueron elegidos al azar después de un período de terapia de tratamiento para continuar con la terapia triple o la combinación de terapia LAMA con la interrupción de los corticosteroides inhalados. La frecuencia de exacerbaciones fue equivalente en ambos grupos de tratamiento, lo que sugiere que l9os corticosteroides inhalado pueden suspenderse de forma segura para muchos pacientes.
Un análisis de subgrupos post hoc encontró que después de su suspensión, los pacientes con ≥2% de eosinófilos en sangre periférica tuvieron un riesgo de exacerbación 22% más elevado que los pacientes con niveles más bajos.
Estos resultados han sido replicados prospectivamente en el ensayo SUNSET, que también mostró que los niveles de eosinófilos en sangre periférica debe ser considerados cuando se suspenden los corticosteroides inhalados.
| Variedad de compuestos y dispositivos dentro de las clases de fármacos |
Aunque no hay estudios comparativos directos más largos de los diferentes compuestos LAMA, LABA y corticosteroides inhalados y combinaciones que hayan demostrado diferentes niveles de mejoría del FEV1, para establecer la superioridad de los medicamentos individuales que mejoren los síntomas o el riesgo de exacerbaciones.
Consideraciones tales como formulario, costo, atributos del dispositivo inhalador y preferencia del paciente deben influi8r en las decisiones de la prescripción del inhalador. Para los pacientes que no responden satisfactoriamente se pueden cambiar los medicamentos y dispositivos en la misma categoría terapéutica, ya que puede ser efectivo.
La adherencia a los medicamentos inhalados, definida como el uso técnicamente correcto del dispositivo, en al menos el 80% de los horarios estipulados es tan baja como 6%. La adherencia adecuada se asocia con mayor eficacia terapéutica, menor hospitalización por exacerbaciones y mayor supervivencia.
Habitualmente se utilizan 3 clases de dispositivos inhaladores:
- inhaladores de dosis medida presurizados
- inhaladores de polvo seco
- inhaladores de niebla suave.
Hay páginas web que capacitan en el uso de inhaladores. Los inhaladores de dosis medidas a presión requieren mayor actuación y destreza en el momento de la inhalación para coordinar la activación mientras que los dispositivos de polvo seco son activados por la respiración solo durante la inspiración.
Los inhaladores de niebla suave son menos sensibles a los errores de coordinación que los inhaladores de dosis medida presurizada, pero requieren mayor destreza para ensamblarlos. Un metaaanálisis identificó tasas de error del 86,8% en el uso de inhaladores de dosis medidas a presión en comparación con el 60,9% con el uso de inhaladores de polvo seco.
Por otra parte, el tiempo requerido para la enseñanza presencial fue de 8 minutos más que para inhaladores de dosis medidas a presión, que fue de 5 minutos con inhaladores de polvo seco.
Los inhaladores de polvo seco requieren mayor flujo inspiratorio para que el medicamento alcance las vías respiratorias inferiores (> 40-60ml/min) que los inhaladores presurizados medidos y de niebla suave (>20l/min), lo que puede resultar en una liberación particularmente inadecuada para los pacientes mayores, las mujeres, y las personas de baja estatura o con capacidad vital forzada disminuida.
Existen dispositivos portátiles para evaluar con exactitud el flujo inspiratorio contra la resistencia a dispositivos simulados.
Como alternativa, a Actualmente se puede hacer tratamiento prolongado con nebulizaciones, con cualquier clase de medicamento inhalado, cuando los pacientes no pueden usar inhaladores a pesar de las instrucciones. Sin embargo, en los pacientes capaces de usar correctamente los inhaladores, la terapia nebulizada no confiere una mejor administración de los fármacos o un beneficio clínico adicional.
| Oxígenoterapia a largo plazo |
Los pacientes con evidencia de disfunción cardiaca derecha en el examen físico o policitemia también pueden beneficiarse del O2 suplementario, con una PaO2 ≤59 mm Hg.
En algunos pacientes que desarrollan hipoxemia solo durante el ejercicio, el tratamiento puede mejorar la disnea de esfuerzo, pero no mejora la supervivencia ni otros beneficios para la salud.
Se desconoce si el tratamiento de la hipoxemia nocturna aislada en pacientes no hipercápnicos, sin apnea del sueño, brinda algún beneficio. Mientras se espera evidencia definitiva, los autores recomiendan la oxigenoterapia nocturna para pacientes con desaturación nocturna aislada (SpO2 ≤88%, durante más de 5 minutos por la noche).
| Rehabilitación pulmonar |
La rehabilitación pulmonar mejora la disnea, las tolerancia al ejercicio y la calidad de vida, en mayor grado que las terapias farmacológicas. A pesar de estos beneficios, menos del 5% de los pacientes elegibles reciben rehabilitación pulmonar.
Los pacientes con deterioro funcional o que no pueden o no quieren realizar ejercicios en forma independiente, pueden beneficiarse de la rehabilitación pulmonar supervisada. Por otra parte, la rehabilitación pulmonar precoz luego de la hospitalización por una exacerbación aguda de la EPOC mejora la mortalidad (10,0% vs. 17.3%) y reduce los reingresos hospitalarios.
Los programas de rehabilitación pulmonar se hacen comúnmente en 2-3 veces sesiones por semana. Si es médicamente necesario, estas sesiones pueden hacerse de por vida.
| Manejo ambulatorio de las exacerbaciones agudas |
Las exacerbaciones leves generalmente se resuelven aumentando la frecuencia de broncodilatadores de acción corta, de rescate. Las exacerbaciones moderadas, definidos en ensayos clínicos y modelos de predicción como aquellos que requieren esteroides sistémicos o antibióticos, pueden ser manejados ambulatoriamente.
Las corta duración de la corticoterapia oral (30-40mg de equivalente de prednisona durante 3-7 días) es tan efectiva como los regímenes prolongados (10-15 días), en cuanto al fracaso terapéutico, recaídas, lapso hasta la próxima exacerbación y recuperación de la función pulmonar después del tratamiento, con menos efectos adversos.
El tratamiento antibiótico reduce el riesgo de fracaso del tratamiento y aumenta el lapso hasta la próxima exacerbación, aunque el efecto es modesto y probablemente atribuible a un subgrupo de pacientes con etiología bacteriana.
Dada la ocurrencia común de colonización bacteriana en los pacientes con EPOC, para definir la etiología bacteriana el cultivo de esputo no es útil.Por lo tanto, para los pacientes con aumento del volumen de esputo y esputo purulento, como tratamiento de primera línea se recomiendan los antibióticos orales como trimetoprima más sulfametoxazol, doxiciclina o macrólidos, mientras que las quinolonas o la ampicilina más ácido clavulánico están indicados en los pacientes con exacerbaciones repetidas o sospecha de resistencia bacteriana .
La disnea o taquipnea que no se alivian con los broncodilatadores de acción corta, la fiebre, el dolor en el pecho o el aumento del edema de las extremidades inferiores son característicos de las exacerbaciones graves y justifica hacer personalmente una evaluación urgente o en el departamento de emergencias.
La fiebre o el malestar localizado en el pecho representa neumonía y requiere radiografía de tórax. Para los pacientes con hipoxemia nueva o empeorada, disnea persistente, acidemia o taquipnea en reposo luego del uso de broncodilatadores y esteroides sistémicos administrados por un médico, mentalidad alterada o el uso de los músculos respiratorio accesorio distrés respiratorio manifiesto, requieren hospitalización.
Debe considerarse que los pacientes ancianos o frágiles, o que tienen una enfermedad basal grave y los pacientes con comorbilidades cardíacas o cognitivas, especialmente en situaciones con apoyo inadecuado del cuidador del hogar, deben ser considerados como de un umbral más bajo para la admisión hospitalaria.
Dentro de las 48 horas de la evaluación en el departamento de emergencias o la hospitalización, el paciente debe ser contactado para verificar la estabilidad y hacer el seguimiento ambulatorio 1 semana después, para confirmar la resolución y optimizar la terapia, con el fin de prevenir la recurrencia.
| Enfoque del paciente con síntomas persistentes o exacerbaciones recurrentes |
El nivel del flujo de aire depende del grado en que contribuyen el enfisema parenquimatoso versus la bronquitis crónica o el grado de hiperinflación pulmonar y el deterioro de la difusión. Otras patologías pulmonares asociadas y comorbilidades sistémicas también pueden influir, independientemente de los síntomas y los resultados.
| Evaluación de las comorbilidades |
La EPOC se asocia de forma independiente con mayor prevalencia con la enfermedad arterial coronaria y la hipertensión arterial. La coexistencia de insuficiencia cardíaca puede contribuir a empeorar los síntomas.
El reflujo gastroesofágico relacionado con la hiperinflación pulmonar asociado a la pérdida de la integridad del esfínter gastroesofágico predispone a la deglución defectuosa, el reflujo, la microaspiración y un mayor riesgo de infecciones del tracto respiratorio inferior y progresión de la EPOC.
En aproximadamente el 30% de los pacientes con EPOC se produce apnea obstructiva del sueño se que contribuye a la fatiga y la disminución del estado funcional. Los pacientes con EPOC tienen mayor prevalencia (85%) de ansiedad que la población general (15.1% vs. prevalencia global del 6,3%, respectivamente), mientras que la depresión se asocia con escasa adherencia a los medicamentos y mayores tasas de hospitalización
La disfunción muscular de las extremidades y la caquexia son prevalentes en la EPOC y se asocian con mayores tasas de hospitalización y muerte.Las tasa de osteopenia son 2,2 y 3,6 veces más en los pacientes con enfisema leve o más grave (53,6% de prevalencia en pacientes sin enfisema vs. 71,8% con traza a leve y, 80,6% con enfisema moderado a severo). En el contexto de la EPOC, las fracturas por compresión vertebral relacionadas con la osteoporosis puede disminuir aún más la función pulmonar.
| Otras enfermedades pulmonares asociadas |
La infección micobacteriana atípica puede provocar infiltrados pulmonares lentamente progresivos y aumentar los síntomas.
No se conoce muy b8ien la coexistencia de bronquiectasias y EPOC y se asocia con mayores síntomas, exacerbaciones más frecuentes y peor pronóstico. La superposición de asma, representada por más de 12% de reversibilidad con los broncodilatadores y un antecedente importante de alergia o asma previa, son indicadores del uso precoz de corticosteroides inhalados.
| Pruebas adicionales |
Las pruebas más completas, como la capacidad de difusión y las mediciones pletismográficas del volumen pulmonar pueden identificar las deficiencias en la difusión del gas o la hiperinflación, lo que pueden influir desproporcionadamente en los síntomas.
La evaluación de la saturación de O2 durante el ejercicio, mediante la oximetría de pulso durante la caminata en una cinta caminadora o en un pasillo o escaleras, acompañado por un médico, puede identificar la hipoxemia por esfuerzo como una causa de intolerancia al ejercicio. cuando la disnea es desproporcionada con la disfunción pulmonar o no responde al tratamiento se debe realizar una ecocardiografía.
| Terapia farmacológica para pacientes con exacerbaciones persistentes |
Los eventos adversos gastrointestinales (náuseas, diarrea, pérdida de peso) pueden motivar tasas significativas de abandono. El tratamiento debe iniciarse con 250 μg durante las primeras 4 semanas para luego continuar con 500 μg/día. La mayoría de los expertos reservan el roflumilast para pacientes con exacerbaciones persistentes a pesar de la terapia triple; debe usarse con cautela en los pacientes con bajo peso y aquellos con antecedentes de depresión.
La administración a largo plazo de 250 mg/día o 500 mg, 3 veces/semana de azitromicina, un antibiótico macrólido, puede reducir el riesgo de exacerbaciones entre un 27% y un 42%. Este fármaco no ha demostrado eficacia en pacientes hospitalizados que siguen fumando.
Sus efectos adversos con el uso crónico son el deterioro auditivo reversible, las arritmias y la generación de resistencia a los macrólidos. Los autores del estudio recomiendan un electrocardiograma basal para evaluar si existe una prolongación del intervalo QT de 450 milisegundos antes de la iniciación y monitorear la audiometría solo si hay síntomas de déficit auditivo.
La mayoría de los expertos considera la azitromicina solo para los fumadores con exacerbaciones persistentes a pesar de la triple terapia.
| Otros tratamientos farmacológicos |
La teofilina no reduce las tasas de exacerbación y en general, no se utiliza.
Los mucolíticos orales en dosis altas, como la N-acetilcisteína (600 mg, 2 veces/día) puede reducir las exacerbaciones, pero no han sido estudiados en pacientes que utilizan al mismo tiempo, terapias de mantenimiento inhaladas.
| Derivación al especialista para tratamientos avanzados |
Las terapias a considerar incluyen la ventilación con no invasiva presión positiva de dos niveles, mediante mascarilla facial para la insuficiencia respiratoria hipercápnica crónica, reducción del volumen pulmonar mediante cirugía o abordajes broncoscópicos para pacientes con enfisema severo e hiperinflación pulmonar y, evaluación del trasplante de pulmón en presencia de deterioro funcional severo para pacientes <70 años..
Conclusiones
|
































No hay comentarios:
Publicar un comentario