
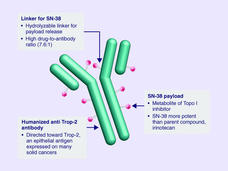
- Se aprobó el sacituzumab govitecán para tratar el cáncer de seno (mama) metastásico triple negativoLa FDA aprobó el sacituzumab govitecán (Trodelvy) para tratar el cáncer de seno triple negativo que se diseminó a otras partes del cuerpo. El medicamento se aprobó para el uso en pacientes que ya recibieron al menos dos regímenes de tratamiento anteriores.
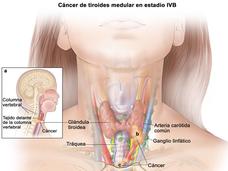
- Se aprueba el uso del selpercatinib para el cáncer de tiroides y cáncer de pulmón con alteraciones en el gen RETLa FDA otorgó la aprobación acelerada del medicamento selpercatinib (Retevmo) para tratar a pacientes de cáncer de tiroides o cáncer de pulmón de células no pequeñas cuyos tumores presentan alteraciones en el gen RET. El medicamento, que impide la actividad de las proteínas RET, se aprobó a partir de los resultados del estudio LIBRETTO-001.
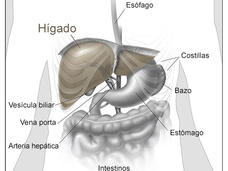
- Se aprobó la combinación de atezolizumab y bevacizumab para tratar el cáncer de hígadoLa FDA aprobó el atezolizumab (Tecentriq) y el bevacizumab (Avastin) como tratamiento inicial del cáncer de hígado avanzado en algunas personas. Esta es la primera aprobación en 13 años de un tratamiento que es más eficaz que el sorafenib, el estándar actual.
- Se aprobó la combinación de encorafenib con cetuximab para tratar el cáncer metastásico colorrectalLa Administración de Alimentos y Medicamentos (FDA) aprobó el uso del encorafenib (Braftovi) en combinación con el cetuximab (Erbitux) para tratar a adultos con cáncer metastásico colorrectal cuyos tumores presentan una mutación en el gen BRAF llamada V600E.
- La FDA aprueba el selumetinib para tratar a niños con neurofibromatosis de tipo 1La Administración de Alimentos y Medicamentos (FDA) aprobó el selumetinib (Koselugo) para tratar a niños con neurofibromatosis de tipo 1 (NF1), un trastorno genético que produce tumores llamados neurofibromas plexiformes en todo el cuerpo.
- Se aprobó el avapritinib para tratar tumores del estroma gastrointestinal con una alteración genética poco comúnSe aprobó Avapritinib (Ayvakit) en algunos adultos con TEGI, cuyos tumores presentan una alteración en una parte del gen PDGFRA llamada exón 18. La aprobación es solo para pacientes con tumores que no se pueden extirpar con cirugía o que se diseminaron a otros lugares del cuerpo.
- Se aprueba el enfortumab vedotina para el cáncer de vejiga recidivanteSe aprueba el enfortumab vedotina-ejfv (Padcev) para las personas con cáncer de vejiga avanzado. La FDA otorgó la aprobación acelerada del medicamento para tratar cánceres que progresaron a pesar de los tratamientos anteriores.
- Nuevos tratamientos para el cáncer de seno metastásico positivo para HER2El tucatinib mejoró la supervivencia de las mujeres en el estudio HER2CLIMB, entre estas, algunas cuyo cáncer se había diseminado al cerebro. El trastuzumab deruxtecán mejoró la supervivencia de las pacientes y achicó muchos tumores en el estudio DESTINY-Breast01, que condujo a la aprobación acelerada del medicamento.
- La FDA aprueba el entrectinib basándose en las características genéticas del tumor y no en el tipo de cáncerLa FDA ha aprobado entrectinib (Rozlitrek) para el tratamiento de niños y adultos con tumores portadores de una fusión en el gen NTRK. La aprobación incluye también a adultos con cáncer de pulmón de células no pequeñas que albergan una fusión en el gen ROS1.
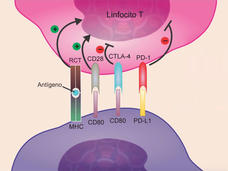
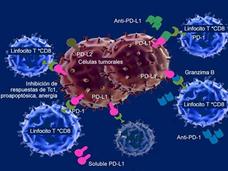
- El medicamento pembrolizumab fue aprobado para algunos pacientes con cáncer avanzado de esófagoLa Administración de Alimentos y Medicamentos (FDA) aprobó el medicamento de inmunoterapia pembrolizumab (Keytruda) para tratar a algunos pacientes con cáncer avanzado de esófago. Los pacientes deben tener ciertos niveles de la proteína PD-L1 en sus tumores, los cuales se determinan con una prueba aprobada por la FDA.
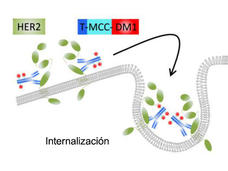
- Se amplió la aprobación de T-DM1 para incluir a algunas mujeres con cáncer de seno con HER2 en estadio inicialLa FDA ha extendido el uso aprobado del fármaco ado-trastuzumab emtansina (Kadcyla), llamado también T-DM1, para que se incluya tratamiento adyuvante en algunas mujeres con cáncer de seno con HER2.
- Terapia de combinación con venetoclax aprobada para leucemia linfocítica crónicaLa Administración de Alimentos y Medicamentos ha aprobado el venetoclax (Venclexta) en combinación con obinutuzumab (Gazyva) para el tratamiento inicial de adultos con leucemia linfocítica crónica o linfoma linfocítico pequeño.
- Atezolizumab aprobado para algunas pacientes con cáncer triple negativo de senoLa FDA ha aprobado el atezolizumab (Tecentriq) en combinación con quimioterapia para el tratamiento de algunas mujeres con cáncer triple negativo avanzado de seno. Este es el primer esquema aprobado por la FDA para cáncer de seno que incluya inmunoterapia.
- Pembrolizumab aprobado ahora como segunda inmunoterapia para el tratamiento del carcinoma de células de MerkelFDA ha aprobado el pembrolizumab (Keytruda) para tratar a personas con carcinoma de células de Merkel, una forma rara y mortal de cáncer de piel. La aprobación cubre el uso del fármaco para tratar localmente formas avanzadas o metastáticas de la enfermedad.
- Se aprobó atezolizumab para el tratamiento inicial de cáncer metastático de pulmónEl 6 de diciembre de 2018, la Administración de Alimentos y Medicamentos (FDA) aprobó el atezolizumab (Tecentriq) en combinación con un esquema convencional de tres fármacos como tratamiento inicial para cáncer avanzado de pulmón que no tiene mutaciones en EGFR o ALK.
- Las aprobaciones de la FDA ofrecen nuevas opciones para pacientes mayores con LMALa FDA ha aprobado venetoclax (Venclexta) y glasdegib (Daurismo) para usarse en personas con leucemia mieloide aguda de 75 años de edad y mayores y quienes tienen padecimientos que les impiden recibir el esquema de quimioterapia intensiva que es el tratamiento inicial convencional.
- Fármaco de inmunoterapia cemiplimab aprobado para cáncer avanzado de piel de células escamosasLa Administración de Alimentos y Medicamentos aprobó el fármaco de inmunoterapia cemiplimab (Libtayo) para una forma avanzada de carcinoma cutáneo de células escamosas (SCC), un tipo común de cáncer de piel. Es la primera sustancia en ser aprobada específicamente para SCC avanzado.
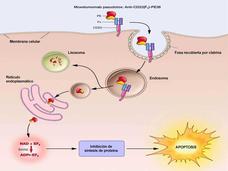
- Moxetumomab aprobado por la FDA para leucemia de células pilosasLa FDA ha aprobado moxetumomab pasudotox (Lumoxiti), un fármaco basado en una toxina bacteriana, para el tratamiento de algunos pacientes con leucemia de células pilosas. Moxetumomab está aprobado para tratar a pacientes con leucemia de células pilosas que ya se han sometido a al menos dos líneas de tratamientos convencionales.
- La FDA modifica el uso aprobado de dos inhibidores de punto de control para cáncer de vejigaLa FDA ha modificado los usos aprobados de los fármacos de inmunoterapia pembrolizumab (Keytruda) y atezolizumab (Tecentriq) para tratar la forma más común de cáncer de vejiga. La modificación se basa en si los tumores de los pacientes tienen un biomarcador específico.
- Se amplía la aprobación de ribociclib para algunas mujeres con cáncer avanzado de senoLa FDA ha ampliado los usos aprobados de ribociclib (Kisqall) para mujeres con cáncer avanzado de seno, incluyendo nuevos usos en mujeres pre- y posmenopáusicas. Esta es la primera aprobación en un nuevo programa de la FDA de acelerar la revisión de fármacos para cáncer.



































No hay comentarios:
Publicar un comentario