
Una proteína para proteger de los efectos secundarios de la radioterapia

Un estudio desarrollado por investigadores del CNIO revela que los niveles elevados de la proteína URI en ratones con síndrome gastrointestinal causado por dosis elevadas de radiación ionizante hacen que regeneren su intestino y sobrevivan en un 100% de los casos.
Uno de los tratamientos contra el cáncer más frecuentes y efectivos es la radioterapia, es decir, el uso de radiación para destruir las células cancerosas y reducir el tamaño de los tumores. En torno a un 50% de los pacientes con tumores localizados en la cavidad gastrointestinal (por ejemplo, cáncer de hígado, páncreas, colon, próstata) se tratan con esta terapia, que en las últimas décadas ha aumentado la supervivencia al cáncer. Sin embargo, la radioterapia intensiva no solo daña a las células tumorales, sino también a las células intestinales sanas, y puede desembocar en toxicidad en el intestino en un 60% de los pacientes sometidos a ella. Aunque es reversible cuando la radioterapia finaliza, un 10% de los pacientes que reciben el tratamiento tienen daños irreversibles y desarrollan el síndrome gastrointestinal, una patología que se caracteriza por la muerte de las células intestinales, lo que conlleva la destrucción del intestino y el fallecimiento de estos pacientes.
Este daño a las células sanas es una de las principales desventajas de la radioterapia, que hace que en muchas ocasiones haya que interrumpirla para no seguir perjudicando al organismo, lo que reduce las posibilidades de éxito de terminar con los tumores. Ahora, científicos del Grupo de Factores de Crecimiento, Nutrientes y Cáncer del Centro Nacional de Investigaciones Oncológicas (CNIO) publican en Science un hallazgo que podría ser de utilidad para proteger las células intestinales sanas del impacto de la radiación. Las implicaciones del descubrimiento, desarrollado en ratones, podrían revolucionar la forma en la que el ser humano se enfrenta a la exposición a grandes dosis de radiación, tanto en la oncología como en otros ámbitos como son los viajes espaciales o los ataques y accidentes nucleares.
La clave de este trabajo está en URI, una proteína de la que aún no se comprenden bien todas sus funciones. Estudios previos del Grupo habían observado que unos niveles de expresión anormales de la proteína en algunos órganos pueden provocar tumores. En este trabajo que ahora publica Science, los investigadores han descubierto que unos niveles altos de la proteína URI protegen a los ratones de los daños intestinales producidos por la radiación, mientras que niveles bajos o su supresión llevan al desarrollo de síndrome gastrointestinal y a su fallecimiento.
"Todavía no se conocen todas las funciones precisas de URI", explica Nabil Djouder, jefe del Grupo de Factores de Crecimiento, Nutrientes y Cáncer del CNIO y autor principal del estudio. "A semejanza del pH o la temperatura, que tienen que mantenerse en unos niveles equilibrados para el correcto funcionamiento del cuerpo, URI también parece contar con una ventana muy estrecha de equilibrio que determina el correcto funcionamiento de otras proteínas: cuando sus niveles están por encima o por debajo de esa ventana, puede promover tumores o proteger contra su desarrollo, así como el de otras enfermedades. Depende mucho del contexto".
URI es un viejo conocido del laboratorio de Djouder, que diseñó los primeros modelos genéticos de ratón para estudiar sus funciones en mamíferos. El equipo ya había observado que niveles elevados de esta proteína tenían un efecto protector contra el daño del ADN en cultivos de células intestinales, por lo que Djouder y la investigadora predoctoral Almudena Chaves-Pérez propusieron explorar si este efecto protector ocurría también in vivo y podría ayudar a paliar los efectos producidos por la radiación, entre ellos, el síndrome gastrointestinal. Para ello, los investigadores crearon tres modelos de ratón modificados genéticamente, los primeros modelos experimentales diseñados para estudiar específicamente el papel de URI y los efectos de la radiación en el intestino: uno de ellos de control para rastrear dónde se expresa exactamente esta proteína en el intestino, otro con niveles altos de URI en este órgano y un tercero en el que eliminaron el gen para disminuir los niveles de URI en el epitelio intestinal.
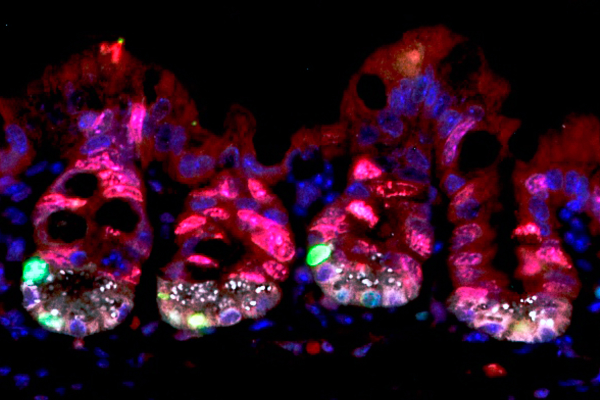 En rojo, las células altamente proliferativas de las criptas intestinales, que se consideran sensibles a la radiación, son afectadas por ella y mueren durante la radioterapia. En verde, células madre durmientes con altos niveles de proteína URI, que se vuelven proliferativas tras la radiación para regenerar el intestino dañado. /CNIO
En rojo, las células altamente proliferativas de las criptas intestinales, que se consideran sensibles a la radiación, son afectadas por ella y mueren durante la radioterapia. En verde, células madre durmientes con altos niveles de proteína URI, que se vuelven proliferativas tras la radiación para regenerar el intestino dañado. /CNIOLos ratones control revelaron que, para proteger y reparar este órgano, URI se expresa en una población específica de células madre durmientes localizadas en unas oquedades intestinales llamadas criptas de Lieberkühn. URI protege a estas células de la toxicidad inducida por niveles altos de radiación. "Hemos descubierto que, una vez finalizada la radioterapia, son estas células las encargadas de regenerar el intestino", explica Chaves-Pérez, primera firmante del trabajo. "Hasta ahora, había mucho debate sobre cuál era la población de células madre encargadas de esta tarea".
Después de ser sometidos a radiación, los ratones diseñados para expresar altos niveles de URI sobrevivieron al síndrome gastrointestinal en un 100% de los casos, cuando, en condiciones normales, fallece hasta un 70% de ellos. En cambio, los ratones sin el gen fallecieron en su totalidad por el síndrome.
Chaves-Pérez explica estos resultados: "Lo que diferencia a esta población específica de células madre de otras es que en estado normal (cuando fabrican URI) son quiescentes, es decir, no proliferan. Esto hace que no se vean sometidas a los daños causados por la radiación, que solo afectan a las células que proliferan. Por otro lado, cuando estas células madre no fabrican URI, se sobreactiva la expresión de c-MYC, un conocido oncogén, lo que hace que proliferen y mueran debido a los daños causados por la radiación. Esto impide que el intestino se regenere, lo que hace que deje de ser funcional y el ratón fallezca".
Aunque necesita ser confirmado en próximos estudios, Djouder cree que los inhibidores de c-MYC podrían ser de utilidad para paliar el síndrome gastrointestinal inducido por la radiación en pacientes. "Este estudio propone nuevos tratamientos mediante inhibición o eliminación de c-MYC, que podrían disminuir los efectos secundarios letales de la radioterapia y permitirían aumentar las dosis de radiación para combatir de manera más eficaz los tumores gastrointestinales", explica Djouder. El investigador añade que "además de proteger frente a los efectos secundarios, los inhibidores contra c-MYC se usan también para el tratamiento del cáncer, por lo que podríamos tener una eficacia doble".
También sería interesante saber si en otros órganos con gran capacidad regenerativa, como por ejemplo la piel, puede haber ciertas poblaciones de células madre con niveles altos de URI, una posibilidad que Djouder y su equipo ya están explorando.
Aparte del ámbito oncológico, Djouder cree que "este descubrimiento podría ayudar a proteger al organismo de los efectos secundarios de altas dosis de radiaciones emitidas durante los accidentes y los ataques nucleares o la exposición a los rayos cósmicos que, a día de hoy, hace que sean inviables los viajes espaciales de larga duración".
El estudio ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades con el Fondo Europeo de Desarrollo Regional, "la Caixa" y el Instituto de Salud Carlos III.
FOTO PRINCIPAL. De izda. a dcha.: Nabil Djouder, jefe del Grupo de Factores de Crecimiento, Nutrientes y Cáncer del CNIO, y Almudena
Chaves-Pérez, investigadora predoctoral./CNIO
por IM Médico Publimas Digital s.l.
































No hay comentarios:
Publicar un comentario